Veiledning for kjemi. Alkalimetaller og deres forbindelser Kaliumjodidløsning ble behandlet med overskudd av klorvann
Oppgaver C 2 (2013)
Reaksjoner som bekrefter forholdet mellom ulike klasser av uorganiske stoffer
Kobber(II)oksid ble oppvarmet i en strøm av karbonmonoksid. Det resulterende stoffet ble brent i en kloratmosfære. Reaksjonsproduktet ble oppløst i vann. Den resulterende løsningen ble delt i to deler. En løsning av kaliumjodid ble tilsatt til den ene delen, og en løsning av sølvnitrat ble tilsatt til den andre. I begge tilfeller ble det observert dannelse av et bunnfall. Skriv ligninger for de fire reaksjonene som er beskrevet.
Kobbernitrat ble kalsinert, og det resulterende faste stoffet ble oppløst i fortynnet svovelsyre. Løsningen av det resulterende salt ble utsatt for elektrolyse. Stoffet som ble frigjort ved katoden ble oppløst i konsentrert salpetersyre. Oppløsningen fortsatte med frigjøring av brun gass. Skriv ligninger for de fire reaksjonene som er beskrevet.
Jernet ble brent i en kloratmosfære. Den resulterende substans ble behandlet med et overskudd av natriumhydroksidløsning. Det dannet seg et brunt bunnfall som ble filtrert og kalsinert. Resten etter kalsinering ble oppløst i jodhydrogensyre. Skriv ligninger for de fire reaksjonene som er beskrevet.
Aluminiummetallpulver ble blandet med fast jod og noen dråper vann ble tilsatt. En løsning av natriumhydroksid ble tilsatt til det resulterende salt inntil det ble dannet et bunnfall. Det resulterende bunnfallet ble oppløst i saltsyre. Ved påfølgende tilsetning av natriumkarbonatløsning ble det igjen observert utfelling. Skriv ligninger for de fire reaksjonene som er beskrevet.
Som et resultat av ufullstendig forbrenning av kull ble det oppnådd en gass, i strømmen som jern(III)oksid ble oppvarmet. Den resulterende substans ble oppløst i varm konsentrert svovelsyre. Den resulterende saltløsningen ble utsatt for elektrolyse. Skriv ligninger for de fire reaksjonene som er beskrevet.
En viss mengde sinksulfid ble delt i to deler. En av dem ble behandlet med salpetersyre, og den andre ble skutt i luft. Når de frigjorte gassene vekselvirket, ble det dannet et enkelt stoff. Dette stoffet ble varmet opp med konsentrert salpetersyre, og en brun gass ble frigjort. Skriv ligninger for de fire reaksjonene som er beskrevet.
Svovel ble smeltet sammen med jern. Reaksjonsproduktet ble oppløst i vann. Gassen som ble frigjort ble brent i overskudd av oksygen. Forbrenningsproduktene ble absorbert av en vandig løsning av jern(III)sulfat. Skriv ligninger for de fire reaksjonene som er beskrevet.
Jernet ble brent i klor. Det resulterende saltet ble tilsatt til natriumkarbonatløsningen, og det ble dannet et brunt bunnfall. Dette bunnfallet ble filtrert og kalsinert. Den resulterende substans ble oppløst i hydrojodsyre. Skriv ligninger for de fire reaksjonene som er beskrevet.
En løsning av kaliumjodid ble behandlet med et overskudd av klorvann, og først ble dannelsen av et bunnfall observert, og deretter den fullstendige oppløsningen. Den resulterende jodholdige syren ble isolert fra løsningen, tørket og forsiktig oppvarmet. Det resulterende oksidet reagerte med karbonmonoksid. Skriv ned ligningene for reaksjonene som er beskrevet.
Krom(III)sulfidpulver ble oppløst i svovelsyre. Samtidig ble gass frigjort og en farget løsning ble dannet. Et overskudd av ammoniakkløsning ble tilsatt til den resulterende løsning, og gassen ble ført gjennom blynitrat. Det resulterende sorte bunnfallet ble hvitt etter behandling med hydrogenperoksid. Skriv ned ligningene for reaksjonene som er beskrevet.
Aluminiumspulver ble oppvarmet med svovelpulver, og det resulterende stoffet ble behandlet med vann. Det resulterende bunnfallet ble behandlet med et overskudd av en konsentrert oppløsning av kaliumhydroksid inntil det var fullstendig oppløst. En løsning av aluminiumklorid ble tilsatt til den resulterende løsning og dannelsen av et hvitt bunnfall ble igjen observert. Skriv ned ligningene for reaksjonene som er beskrevet.
Kaliumnitrat ble oppvarmet med pulverisert bly inntil reaksjonen stoppet. Blandingen av produkter ble behandlet med vann, og deretter ble den resulterende løsningen filtrert. Filtratet ble surgjort med svovelsyre og behandlet med kaliumjodid. Det isolerte enkle stoffet ble oppvarmet med konsentrert salpetersyre. Rødt fosfor ble brent i atmosfæren til den resulterende brune gassen. Skriv ned ligningene for reaksjonene som er beskrevet.
Kobber ble oppløst i fortynnet salpetersyre. Et overskudd av ammoniakkløsning ble tilsatt til den resulterende løsningen, først observerte dannelsen av et bunnfall, og deretter dens fullstendige oppløsning med dannelsen av en mørkeblå løsning. Den resulterende løsningen ble behandlet med svovelsyre inntil den karakteristiske blå fargen til kobbersalter viste seg. Skriv ned ligningene for reaksjonene som er beskrevet.
Magnesium ble oppløst i fortynnet salpetersyre, og ingen gassutvikling ble observert. Den resulterende løsningen ble behandlet med et overskudd av kaliumhydroksidløsning under oppvarming. Gassen som ble frigjort ble brent i oksygen. Skriv ned ligningene for reaksjonene som er beskrevet.
En blanding av kaliumnitritt og ammoniumkloridpulver ble oppløst i vann og oppløsningen ble forsiktig oppvarmet. Den frigjorte gassen reagerte med magnesium. Reaksjonsproduktet ble tilsatt til et overskudd av saltsyreløsning, og ingen gassutvikling ble observert. Det resulterende magnesiumsalt i løsning ble behandlet med natriumkarbonat. Skriv ned ligningene for reaksjonene som er beskrevet.
Aluminiumoksid ble smeltet sammen med natriumhydroksid. Reaksjonsproduktet ble tilsatt til en løsning av ammoniumklorid. Den frigjorte gassen med en skarp lukt absorberes av svovelsyre. Det resulterende mediumsaltet ble kalsinert. Skriv ned ligningene for reaksjonene som er beskrevet.
Klor reagerte med en varm løsning av kaliumhydroksid. Etter hvert som løsningen avkjølte seg utfelte krystaller av Berthollet-salt. De resulterende krystallene ble tilsatt til en løsning av saltsyre. Det resulterende enkle stoffet reagerte med metallisk jern. Reaksjonsproduktet ble oppvarmet med en ny porsjon jern. Skriv ned ligningene for reaksjonene som er beskrevet.
Kobber ble oppløst i konsentrert salpetersyre. Et overskudd av ammoniakkløsning ble tilsatt til den resulterende løsningen, og observerte først dannelsen av et bunnfall og deretter fullstendig oppløsning. Den resulterende løsning ble behandlet med overskudd av saltsyre. Skriv ned ligningene for reaksjonene som er beskrevet.
Jern ble oppløst i varm konsentrert svovelsyre. Det resulterende saltet ble behandlet med et overskudd av natriumhydroksidløsning. Det brune bunnfallet som ble dannet ble filtrert og kalsinert. Det resulterende stoffet ble smeltet sammen med jern. Skriv ligninger for de fire reaksjonene som er beskrevet.
|
1)CuO + CO=Cu+CO 2 2) Cu+Cl2 = CuCl2 3) 2CuCl2 +2KI=2CuCl↓ +I2 +2KCl 4) CuCl 2 +2AgNO 3 =2AgCl↓+Cu(NO 3) 2 |
1)Cu(NO 3) 2 2CuO+4NO 2 +O 2 2) CuO+2H 2 SO 4 = CuSO 4 + SO 2 + 2H 2 O 3) CuSO 4 + H 2 O = Cu↓ + H 2 SO 4 + O 2 (velg 4)Cu+4HNO3 =Cu(NO3)2 +2NO2 +2H2O |
1) 2Fe + 3Cl 2 = 2FeCl 3 2)FeCl3 + 3NaOH = Fe(OH)3 ↓+3NaCl 4) Fe 2 O 3 + 6HI = 2FeI 2 + I 2 + 3H 2 O |
|
1) 2Al+3I2 = 2AlI3 2) AlI3 +3NaOH= Al(OH)3 +3NaI 3)Al(OH)3 + 3HCl= AlCl3 + 3H2O 4)2AlCl3 +3Na2CO3 +3H2O=2Al(OH)3 +3CO2 +6NaCl |
2) Fe 2 O 3 +CO=Fe+CO 2 3)2Fe+6H 2SO 4 =Fe 2 (SO 4) 3 +3SO 2 +6H 2 O 4)Fe 2 (SO 4) 3 +4H 2 O=2Fe+H 2 +3H 2 SO 4 + O 2 (elektrolyse) |
1) ZnS+2HNO3 =Zn(NO3)2+H2S 2)2ZnS +3O2 =2ZnO +2SO2 3)2H2S+SO2=3S↓+2H2O 4)S+6HNO3 =H2SO4 +6NO2 +2H2O |
|
2) FeS + 2H2O=Fe(OH)2+H2S 3)2H2S+3O22SO2+2H2O 4)Fe 2 (SO 4) 3 + SO 2 + 2H 2 O=2FeSO 4 + 2H 2 SO 4 |
1) 2Fe + 3Cl 2 = 2FeCl 3 2)2FeCl3 +3Na2CO3 =2Fe(OH)3 +6NaCl+3CO2 3) 2Fe(OH)3Fe2O3 + 3H2O 4) Fe 2 O 3 + 6HI = 2FeI 2 + I 2 + 3H 2 O |
1)2KI+Cl2=2KCl+I2 2)I2+5Cl2+6H2O=10HCl+2HIO3 3)2HIO3I2O5 + H2O 4) I 2 O 5 +5CO = I 2 +5CO 2 |
|
1)Cr2S3 +3H2SO4 =Cr2(SO4)3 +3H2S 2)Cr 2 (SO 4) 4 +6NH 3 + 6H 2 O=2Cr(OH) 3 ↓+3(NH 4) 2 SO 4 3)H 2S+Pb(NO 3) 2 =PbS↓+2HNO 3 4)PbS+4H2O2=PbS04+4H2O |
1)2Al+3S Al2S 3 2)Al 2S 3 +6H 2 O=2Al(OH) 3 ↓+3H 2S 3)Al(OH)3+KOH=K 4)3K+AlCl3 =3KCl+Al(OH)3 ↓ |
1)KNO 3 +Pb KNO 2 +PbO 2)2KNO2 +2H2SO4 +2KI=2K2SO4 + 2NO+I2 +2H2O 3)I 2 +10HNO 3 2HIO 3 +10NO 2 +4H 2 O 4)10NO2 +P=2P205 +10NO |
|
1)3Cu+8HNO3 =3Cu(NO3)2 +2NO+4H2O 4)(OH)2 +3H2SO4 = CuSO4+2(NH4)2SO4 + 2H2O |
1)4Mg+10HNO3 = 4Mg(NO3)2 +NH4NO3 + 3H2O 2) Mg(NO 3) 2 +2KOH=Mg(OH) 2 ↓+2KNO 3 3)NH4NO3 +KOHKNO3 +NH3 +H2O 4)4NH3+3O2=2N2+6H2O |
1) KNO2 +NH4Cl KCl+N2 +2H2O 2) 3Mg+N2 =Mg3N2 3)Mg3N2+8HCl=3MgCl2+2NH4Cl 4)2MgCl 2 +2Na 2 CO 3 + H 2 O= (MgOH) 2 CO 3 ↓+ CO 2 + 4 NaCl |
|
1) Al 2 O 3 + 2 NaOH 2 NaAlO 2 + H 2 O 2)NaAlO 2 +NH 4 Cl+H 2 O=NaCl+ Al(OH) 3 ↓+NH 3 3)2NH3+H2SO4 =(NH4)2SO4 4)(NH 4) 2 SO 4 NH 3 + NH 4 HSO 4 |
1)3Cl2 +6KOH6KCl+KClO3 +3H2O 2)6HCl+KClO3 =KCl+3Cl2 +3H2O 3)2Fe+3Cl2 =2FeCl3 4)2FeCl3 +Fe3FeCl2 |
1)3Cu+4HNO3 =3Cu(NO3)2 +2NO2 +4H2O 2) Cu(NO 3) 2 +2NH 3 H 2 O=Cu(OH) 2 + 2NH 4 NO 3 3) Cu(OH) 2 +4NH 3 H 2 O =(OH) 2 + 4H 2 O 4)(OH)2 +6HCl= CuCl2 +4NH4Cl + 2H2O |
|
19 Dokument C 2 Reaksjoner, bekrefter forhold diverse klasser uorganisk stoffer Gitt vandige løsninger... Skriv likninger for de fire mulige reaksjoner. Er gitt stoffer: hydrobromsyre, ... utfelles under reaksjoner substans gul farge brent på... Sammendragsrapport fra styrelederne for fagkommisjoner i Astrakhan-regionen om akademiske emner for statens endelige sertifisering for utdanningsprogrammer for videregående generell utdanningRapportere4 21,9 40,6 C2 Reaksjoner, bekrefter forhold diverse klasser uorganisk stoffer 54,1 23,9 9,9 7,7 4,3 C3 Reaksjoner, bekrefter forhold organiske forbindelser 56,8 10 ... Kalendertematisk planlegging av klasser som forberedelse til Unified State-eksamen i kjemi i studieåret 2013–2014.Kalender og tematisk planlegging25) 27.03.2014 Reaksjoner, bekrefter forhold diverse klasser uorganisk stoffer. Løsning av øvelser C-2...enkelt stoffer. Kompleksets kjemiske egenskaper stoffer. Forhold diverse klasser uorganisk stoffer. Reaksjoner Ionbytte... Kalendertematisk leksjonsplan for forberedelse til Unified State Exam in Chemistry for skolekandidater i Barnaul og Altai-territoriet i 2015. LeksjonsnummerKalendertematisk plan... (ved å bruke eksemplet med aluminium og sinkforbindelser). Forhold uorganisk stoffer. Reaksjoner, bekrefter forhold diverse klasser uorganisk stoffer(37 (C2)). 28. februar 2015... |
Lærer i kjemi
LEKSJON 10
10. klasse(første studieår)
Fortsettelse. For begynnelsen, se nr. 22/2005; 1, 2, 3, 5, 6, 8, 9, 11/2006
Redoksreaksjoner
Plan
1. Oksidasjon-reduksjonsreaksjoner (ORR), oksidasjonsgrad.
2. Oksidasjonsprosess, de viktigste reduksjonsmidlene.
3. Reduksjonsprosessen, de viktigste oksidasjonsmidlene.
4. Redoks-dualitet.
5. Hovedtyper av ORR (intermolekylær, intramolekylær, disproporsjonering).
6. ORR-verdi.
7. Metoder for å sammenstille ORR-ligninger (elektronisk og elektron-ionebalanse).
Alle kjemiske reaksjoner basert på endringer i oksidasjonstilstandene til de involverte atomene kan deles inn i to typer: ORR (de som skjer med en endring i oksidasjonstilstander) og ikke-ORR.
Oksidasjonstilstand– den betingede ladningen til et atom i et molekyl, beregnet ut fra antakelsen om at det kun eksisterer ioniske bindinger i molekylet.
Regler for å bestemme graden av oksidasjon
Oksydasjonstilstanden til atomer til enkle stoffer er null.
Summen av oksidasjonstilstandene til atomer i et komplekst stoff (i et molekyl) er null.
Oksydasjonstilstanden til alkalimetallatomer er +1.
Oksydasjonstilstanden til jordalkalimetallatomer er +2.
Oksydasjonstilstanden til bor- og aluminiumatomer er +3.
Oksydasjonstilstanden til hydrogenatomer er +1 (i hydrider av alkali- og jordalkalimetaller -1).
Oksydasjonstilstanden til oksygenatomer er –2 (i peroksider –1).
Enhver ORR er et sett med prosesser for elektrondonasjon og tilsetning.
Prosessen med å gi fra seg elektroner kalles oksidasjon. Partikler (atomer, molekyler eller ioner) som donerer elektroner kalles restauratører. Som et resultat av oksidasjon øker oksidasjonstilstanden til reduksjonsmidlet. Reduksjonsmidler kan være partikler i lavere eller mellomliggende oksidasjonstilstander. De viktigste reduksjonsmidlene er: alle metaller i form av enkle stoffer, spesielt aktive; C, CO, NH 3, PH 3, CH 4, SiH 4, H 2 S og sulfider, hydrogenhalogenider og metallhalogenider, metallhydrider, metallnitrider og fosfider.
Prosessen med å legge til elektroner kalles restaurering. Partikler som aksepterer elektroner kalles oksidasjonsmidler. Som et resultat av reduksjon avtar oksidasjonstilstanden til oksidasjonsmidlet. Oksidasjonsmidler kan være partikler i høyere eller mellomliggende oksidasjonstilstander. De viktigste oksidasjonsmidlene: enkle ikke-metalliske stoffer med høy elektronegativitet (F 2, Cl 2, O 2), kaliumpermanganat, kromater og dikromater, salpetersyre og nitrater, konsentrert svovelsyre, perklorsyre og perklorater.
Det er tre typer redoksreaksjoner.
Intermolekylær OVR - et oksidasjonsmiddel og et reduksjonsmiddel er inkludert i forskjellige stoffer, for eksempel:

Intramolekylært OVR – et oksidasjonsmiddel og et reduksjonsmiddel er en del av ett stoff. Dette kan være forskjellige elementer, for eksempel:

eller ett kjemisk grunnstoff i forskjellige oksidasjonstilstander, for eksempel:

Disproporsjonering (autooksidasjon-selvhelbredende)– oksidasjonsmidlet og reduksjonsmidlet er det samme grunnstoffet, som er i en mellomliggende oksidasjonstilstand, for eksempel:

ORR er av stor betydning, siden de fleste reaksjoner som forekommer i naturen tilhører denne typen (fotosynteseprosess, forbrenning). I tillegg brukes ORR aktivt av mennesker i deres praktiske aktiviteter (reduksjon av metaller, syntese av ammoniakk):

For å kompilere ORR-ligninger kan du bruke metoden elektronisk balanse (elektroniske kretser) eller elektron-ionebalansemetoden.
Elektronisk balansemetode:
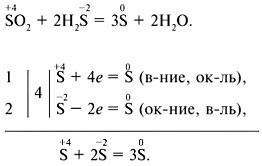
Elektron-ion-balansemetode:

Test om emnet "Oksidasjonsreduksjonsreaksjoner"
1. Kaliumdikromat ble behandlet med svoveldioksid i en svovelsyreløsning, og deretter med en vandig løsning av kaliumsulfid. Det endelige stoffet X er:
a) kaliumkromat; b) krom(III)oksid;
c) krom(III)hydroksid; d) krom(III)sulfid.
2. Hvilket reaksjonsprodukt mellom kaliumpermanganat og hydrobromsyre kan reagere med hydrogensulfid?
a) Brom; b) mangan(II)bromid;
c) mangandioksid; d) kaliumhydroksid.
3. Oksydasjonen av jern(II)jodid med salpetersyre produserer jod og nitrogenmonoksid. Hva er forholdet mellom koeffisienten til oksidasjonsmidlet og koeffisienten til reduksjonsmidlet i ligningen for denne reaksjonen?
a) 4:1; b) 8:3; kl 11; d) 2:3.
4. Oksydasjonstilstanden til karbonatomet i bikarbonationet er lik:
a) +2; b) -2; c) +4; d) +5.
5. Kaliumpermanganat i et nøytralt miljø reduseres til:
a) mangan; b) mangan(II)oksid;
c) mangan(IV)oksid; d) kaliummanganat.
6. Summen av koeffisientene i ligningen for reaksjonen av mangandioksid med konsentrert saltsyre er lik:
a) 14; b) 10; klokken 6; d) 9.
7. Av de listede forbindelsene er det bare følgende som har oksiderende evne:
a) svovelsyre; b) svovelsyrling;
c) hydrosulfidsyre; d) kaliumsulfat.
8. Av de listede forbindelsene vises redoksdualitet av:
a) hydrogenperoksid; b) natriumperoksid;
c) natriumsulfitt; d) natriumsulfid.
9. Av følgende typer reaksjoner er redoksreaksjoner:
a) nøytralisering; b) restaurering;
c) disproporsjonering; d) bytte.
10. Oksydasjonstilstanden til et karbonatom faller ikke numerisk sammen med dets valens i stoffet:
a) karbontetraklorid; b) etan;
c) kalsiumkarbid; d) karbonmonoksid.
Nøkkelen til testen
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| V | EN | EN | V | V | G | a, d | a B C | b, c | b, c |
Øvelser om redoksreaksjoner
(elektronisk og elektron-ion balanse)
Oppgave 1. Lag OVR-ligninger ved hjelp av den elektroniske balansemetoden, bestem type OVR.
1. Sink + kaliumdikromat + svovelsyre = sinksulfat + krom(III)sulfat + kaliumsulfat + vann.
Elektronisk balanse:

2. Tinn(II)sulfat + kaliumpermanganat + svovelsyre = tinn(IV)sulfat + mangansulfat + kaliumsulfat + vann.
3. Natriumjodid + kaliumpermanganat + kaliumhydroksid = jod + kaliummanganat + natriumhydroksid.
4. Svovel + kaliumklorat + vann = klor + kaliumsulfat + svovelsyre.
5. Kaliumjodid + kaliumpermanganat + svovelsyre = mangan(II)sulfat + jod + kaliumsulfat + vann.
6. Jern(II)sulfat + kaliumdikromat + svovelsyre = jern(III)sulfat + krom(III)sulfat + kaliumsulfat + vann.
7. Ammoniumnitrat = nitrogenoksid (I) + vann.
8. Fosfor + salpetersyre = fosforsyre + nitrogenoksid (IV) + vann.
9. Salpetersyre = salpetersyre + nitrogenoksid (II) + vann.
10. Kaliumklorat + saltsyre = klor + kaliumklorid + vann.
11. Ammoniumdikromat = nitrogen + krom(III)oksid + vann.
12. Kaliumhydroksid + klor = kaliumklorid + kaliumklorat + vann.
13. Svovel(IV)oksid + brom + vann = svovelsyre + hydrobromsyre.
14. Svovel(IV)oksid + hydrogensulfid = svovel + vann.
15. Natriumsulfitt = natriumsulfid + natriumsulfat.
16. Kaliumpermanganat + saltsyre = mangan(II)klorid + klor + kaliumklorid + vann.
17. Acetylen + oksygen = karbondioksid + vann.
18. Kaliumnitritt + kaliumpermanganat + svovelsyre = kaliumnitrat + mangan(II)sulfat + kaliumsulfat + vann.
19. Silisium + kaliumhydroksid + vann = kaliumsilikat + hydrogen.
20. Platina + salpetersyre + saltsyre = platina(IV)klorid + nitrogenoksid(II) + vann.
21. Arsensulfid + salpetersyre = arsensyre + svoveldioksid + nitrogendioksid + vann.
22. Kaliumpermanganat = kaliummanganat + mangan(IV)oksid + oksygen.
23.
Kobber(I)sulfid + oksygen + kalsiumkarbonat = kobber(II)oksyd + kalsiumsulfitt +
+ karbondioksid.
24.
Jern(II)klorid + kaliumpermanganat + saltsyre = jern(III)klorid + klor +
+ mangan(II)klorid + kaliumklorid + vann.
25. Jern(II)sulfitt + kaliumpermanganat + svovelsyre = jern(III)sulfat + mangan(II)sulfat + kaliumsulfat + vann.
Svar på øvelser i oppgave 1


Ved bruk av halvreaksjonsmetoden (elektron-ion-balanse) bør det tas i betraktning at i vandige løsninger skjer bindingen av overflødig oksygen og tilsetningen av oksygen med et reduksjonsmiddel forskjellig i sure, nøytrale og alkaliske medier. I sure løsninger bindes overskudd av oksygen av protoner for å danne vannmolekyler, og i nøytrale og alkaliske løsninger av vannmolekyler for å danne hydroksidioner. Tilsetningen av oksygen av et reduksjonsmiddel utføres i sure og nøytrale miljøer på grunn av vannmolekyler med dannelse av hydrogenioner, og i et alkalisk miljø - på grunn av hydroksidioner med dannelse av vannmolekyler.
Nøytralt miljø:
Alkalisk miljø:
oksidasjonsmiddel + H 2 O = ... + OH – ,
reduksjonsmiddel + OH – = ... + H 2 O.
Surt miljø:
oksidasjonsmiddel + H + = ... + H 2 O,
reduksjonsmiddel + H 2 O = ... + H + .
Oppgave 2. Bruk elektron-ion-balansemetoden, komponer ligninger for redoksreaksjoner som forekommer i et bestemt miljø.
1. Natriumsulfitt + kaliumpermanganat + vann = ......................
2. Jern(II)hydroksid + oksygen + vann = .....................................
3. Natriumbromid + kaliumpermanganat + vann = ..........................
4. Hydrogensulfid + brom + vann = svovelsyre + .......................
5. Sølv(I)nitrat + fosfin + vann = sølv + fosforsyre + ...................................
I ALKALINE MILJØ
1. Natriumsulfitt + kaliumpermanganat + kaliumhydroksid = ......................
2. Kaliumbromid + klor + kaliumhydroksid = kaliumbromat + .......................
3. Mangan(II)sulfat + kaliumklorat + kaliumhydroksid = kaliummanganat + ...................... .
4. Krom(III)klorid + brom + kaliumhydroksid = kaliumkromat + ......................
5. Mangan(IV)oksid + kaliumklorat + kaliumhydroksid = kaliummanganat + ...................... .
I et surt miljø
1. Natriumsulfitt + kaliumpermanganat + svovelsyre = .......................
2. Kaliumnitritt + kaliumjodid + svovelsyre = nitrogenoksid (II) + ......................
3. Kaliumpermanganat + nitrogenoksid (II) + svovelsyre = nitrogenoksid (IV) + ...................... .
4. Kaliumjodid + kaliumbromat + saltsyre = .......................
5. Mangan(II)nitrat + bly(IV)oksid + salpetersyre = mangansyre +
+ ...................... .
Svar på øvelser i oppgave 2
N E U T R A L MILJØ

Oppgave 3. Bruk elektron-ion-balansemetoden, komponer ORR-ligninger.
1. Mangan(II)hydroksid + klor + kaliumhydroksid = mangan(IV)oksid + ...................... .
Elektron-ion balanse:

2. Mangan(IV)oksid + oksygen + kaliumhydroksid = kaliummanganat +..........................
3. Jern(II)sulfat + brom + svovelsyre = .......................
4. Kaliumjodid + jern(III)sulfat = ....................... .
5. Hydrogenbromid + kaliumpermanganat = ...................................
6. Hydrogenklorid + krom(VI)oksid = krom(III)klorid + .......................
7. Ammoniakk + brom = ......................
8. Kobber(I)oksid + salpetersyre = nitrogenoksid(II) + .......................
9. Kaliumsulfid + kaliummanganat + vann = svovel + .......................
10. Nitrogenoksid (IV) + kaliumpermanganat + vann = ......................
11. Kaliumjodid + kaliumdikromat + svovelsyre = ...................................
12. Bly(II)sulfid + hydrogenperoksid = .................................
13. Hypoklorsyre + hydrogenperoksid = saltsyre + ..........................
14. Kaliumjodid + hydrogenperoksid = ...................................
15. Kaliumpermanganat + hydrogenperoksid = mangan(IV)oksid + .....................................
16. Kaliumjodid + kaliumnitritt + eddiksyre = nitrogenoksid (II) + ............................... .
17. Kaliumpermanganat + kaliumnitritt + svovelsyre = ...................................
18. Svovelsyre + klor + vann = svovelsyre + ..........................
19. Svovelsyrling + hydrogensulfid = svovel + ..............................
vanndannelse. Løsningen oppnådd etter å ha ført gasser gjennom vann hadde en sur reaksjon. Når denne løsningen ble behandlet med sølvnitrat, ble det dannet 14,35 g av et hvitt bunnfall. Bestem den kvantitative og kvalitative sammensetningen av den opprinnelige blandingen av gasser. Løsning.
Gassen som brenner for å danne vann er hydrogen, den er lett løselig i vann. Hydrogen med oksygen og hydrogen med klor reagerer eksplosivt i sollys. Det er åpenbart at det var klor i blandingen med hydrogen, fordi den resulterende HC1 er svært løselig i vann og gir et hvitt bunnfall med AgN03.
Således består blandingen av gassene H2 og C1:
1 mol 1 mol
HC1 + AgN03 -» AgCl 4- HN03.
x mol 14,35
Ved behandling av 1 mol HC1 dannes det 1 mol AgCl, og ved behandling av x mol 14,35 g eller 0,1 mol. Mr(AgCl) = 108 + 2 4- 35,5 = 143,5, M(AgCl) = 143,5 g/mol,
v= - = = 0,1 mol,
x = 0,1 mol HC1 var inneholdt i løsningen. 1 mol 1 mol 2 mol H2 4- C12 2HC1 x mol y mol 0,1 mol
x = y = 0,05 mol (1,12 l) hydrogen og klor reagerte for å danne 0,1 mol
NS1. Blandingen inneholdt 1,12 liter klor og 1,12 liter hydrogen + 1,12 liter (overskudd) = 2,24 liter.
Eksempel 6. Det er en blanding av natriumklorid og natriumjodid i laboratoriet. 104,25 g av denne blandingen ble oppløst i vann og overskudd av klor ble ført gjennom den resulterende løsningen, deretter ble løsningen inndampet til tørrhet og resten ble kalsinert til konstant vekt ved 300°C.
Tørrstoffmassen viste seg å være 58,5 g. Bestem sammensetningen av den opprinnelige blandingen i prosent.
Mr(NaCl) = 23 + 35,5 = 58,5, M(NaCl) = 58,5 g/mol, Mr(Nal) = 127 + 23 = 150 M(Nal) = 150 g/mol.
I den opprinnelige blandingen: masse av NaCl - x g, masse av Nal - (104,25 - x) g.
Når natriumklorid og jodid føres gjennom en løsning, fortrenges jod av det. Når det tørre residuet ble ført gjennom, fordampet jodet. Dermed kan bare NaCl være et tørt stoff.
I det resulterende stoffet: masse av initial NaCl x g, masse av det resulterende (58,5-x):
2 150 g 2 58,5 g
2NaI + C12 -> 2NaCl + 12
(104,25 - x) g (58,5 - x) g
2 150 (58,5 - x) = 2 58,5 (104,25 - x)
x = - = 29,25 (g),
de. NaCl i blandingen var 29,25 g, og Nal - 104,25 - 29,25 = 75 (g).
La oss finne sammensetningen av blandingen (i prosent):
w(Nal) = 100 % = 71,9 %,
©(NaCl) = 100 % - 71,9 % = 28,1 %.
Eksempel 7 68,3 g av en blanding av nitrat, jodid og kaliumklorid ble oppløst i vann og behandlet med klorvann. Som et resultat ble 25,4 g jod frigjort (hvis løseligheten i vann ble neglisjert). Den samme løsningen ble behandlet med sølvnitrat. 75,7 g sediment falt. Bestem sammensetningen av den opprinnelige blandingen.
Klor interagerer ikke med kaliumnitrat og kaliumklorid:
2KI + C12 -» 2KS1 + 12,
2 mol - 332 g 1 mol - 254 g
Mg(K1) = 127 + 39 - 166,
x = = 33,2 g (KI var i blandingen).
v(KI) - - = = 0,2 mol.
1 mol 1 mol
KI + AgN03 = Agl + KN03.
0,2 mol x mol
x = = 0,2 mol.
Mr(Agl) = 108 + 127 = 235,
m(Agl) = Mv = 235 0,2 = 47 (r),
da vil AgCl være det
75,7 g - 47 g = 28,7 g.
74,5 g 143,5 g
KCl + AgN03 = AgCl + KN03
X = 1 L = 14,9 (KCl).
Derfor inneholdt blandingen: 68,3 - 33,2 - 14,9 = 20,2 g KN03.
Eksempel 8. For å nøytralisere 34,5 g oleum, forbrukes 74,5 ml av en 40% løsning av kaliumhydroksid. Hvor mange mol svoveloksid (VI) er det per 1 mol svovelsyre?
100 % svovelsyre løser opp svoveloksid (VI) i alle forhold. Sammensetningen uttrykt med formelen H2S04*xS03 kalles oleum. La oss beregne hvor mye kaliumhydroksid som trengs for å nøytralisere H2S04:
1 mol 2 mol
H2S04 + 2KON -> K2S04 + 2Н20 xl mol y mol
y - 2*x1 mol KOH går til å nøytralisere S03 i oleum. La oss beregne hvor mye KOH som trengs for å nøytralisere 1 mol S03:
1 mol 2 mol
S03 4- 2KOH -> K2SO4 + H20 x2 mol z mol
z - 2 x2 mol KOH går til å nøytralisere SOg i oleum. 74,5 ml 40 % KOH-løsning brukes til å nøytralisere oleum, dvs. 42 g eller 0,75 mol KOH.
Derfor er 2 xl + 2x 2 = 0,75,
98 xl + 80 x2 = 34,5 g,
xl = 0,25 mol H2S04,
x2 = 0,125 mol S03.
Eksempel 9 Det er en blanding av kalsiumkarbonat, sinksulfid og natriumklorid. Hvis 40 g av denne blandingen utsettes for overskudd av saltsyre, vil det frigjøres 6,72 liter gasser, som ved interaksjon med overskudd av svoveloksid (IV) vil frigjøre 9,6 g sediment. Bestem sammensetningen av blandingen.
Når blandingen ble utsatt for overskudd av saltsyre, kunne karbonmonoksid (IV) og hydrogensulfid frigjøres. Bare hydrogensulfid reagerer med svovel (IV) oksid, så volumet kan beregnes ut fra mengden bunnfall som frigjøres:
CaC03 + 2HC1 -> CaC12 + H20 + C02t(l)
100 g - 1 mol 22,4 l - 1 mol
ZnS + 2HC1 -> ZnCl2 + H2St (2)
97 g - 1 mol 22,4 l - 1 mol
44,8 l - 2 mol 3 mol
2H2S + S02 -» 3S + 2H20 (3)
xl l 9,6 g (0,3 mol)
xl = 4,48 1 (0,2 mol) H2S; fra ligninger (2 - 3) er det klart at ZnS var 0,2 mol (19,4 g):
2H2S + S02 -> 3S + 2H20.
Det er åpenbart at karbonmonoksid (IV) i blandingen var:
6,72 l - 4,48 l = 2,24 l (C02).
Løsning:
2Cl2 + 2H20 = 4HCl + O2
mp-pa = m(H2O) + m(Cl2) - m(O2);
Am = m(Cl2) - m(O2);
La oss ta n(Cl2) for å være X, deretter n(02) = 0,5x;
La oss lage en algebraisk ligning basert på likheten ovenfor og finne X:
Am = x M(Cl2) - 0,5x M(O2) = x(71 - 16) = 55x;
x = 0,04 mol;
V(Cl2) = n(Cl2) Vm = 0,004 22,4 = 0,896 l.
Svar: 0,896 l.
10. Beregn rekkevidden av tillatte verdier for volumet av klor (nr.) som er nødvendig for fullstendig klorering av 10,0 g av en blanding av jern og kobber.
Løsning:
Siden betingelsen ikke sier hva forholdet mellom metaller i blandingen er, kan vi bare anta at rekkevidden av tillatte verdier for volumet av klor i dette tilfellet vil være området mellom dets volumer som kreves for å klorere 10 g av hver metall separat. Og å løse problemet kommer ned til å finne disse volumene sekvensielt.
2Fe + 3Cl2 = 2FeCl3
Cu + Cl′2 = CuCl2
n(Cl2) = 1,5n(Fe) = 1,5 10/56 = 0,26 mol;
V(Cl2) = n(Cl2) Vm = 0,26 22,4 = 5,99 ≈ 6 l;
n(Cl'2) = n(Cu) = 10/63,5 = 0,16 mol;
V(Cl′2) = 22,4 · 0,16 = 3,5 l.
Svar: 3,5 ≤ V(Cl2) ≤ 6 l.
11. Beregn massen av jod som dannes ved behandling av en blanding av natriumjodiddihydrat, kaliumjodid og magnesiumjodid med et overskudd av en surgjort løsning av kaliumpermanganat, der massefraksjonene av alle salter er like, og den totale mengden av alle stoffer er 50,0 mmol.
Løsning:
La oss skrive ned likningene av reaksjonene som forekommer i løsningen og komponere de generelle halvreaksjonene, på grunnlag av hvilke vi vil ordne koeffisientene:
10NaI 2H2O + 2KMnO4 + 8H2SO4 = 5I2 + 2MnSO4 + 5Na2SO4 + K2SO4 + 28H2O
10KI + 2KMnO4 + 8H2SO4 = 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
5MgI2 + 2KMnO4 + 8H2SO4 = 5I2 + 2MnSO4 + 5MgSO4 + K2SO4 + 8H2O
MnO4¯+ 8H+ + 5ē = Mn2+ + 4H2O 2
2I¯− 2 ē = I2 5
2 MnO4¯+ 16H+ + 10 I¯= 2 Mn2+ + 5I2 + 8H2O
Fra likheten mellom massefraksjonene til komponentene i blandingen følger det at massene deres også er like. Tar dem feil av X La oss lage en algebraisk ligning basert på likheten:
n1 + n2 + n3 = 50,0 mmol
m1/M(NaI 2H2O) + m2/M(KI) + m3/M(MgI2) = 50,0 mmol
m1 = m2 = m3 = x
x/186 + x/166 + x/278 = 50 10-3 mol
m(12)1 = 5M(12) m(NaI 2H20)/10M(NaI 2H20) = (5 254 3,33)/10 186 = 2,27 g;
m(12)2 = 5M(12) m(KI)/10M(KI) = (5 254 3,33)/10 166 = 2,55 g;
m(I2)3 = 5M(I2) m(MgI2)/10M(MgI2) = (5 254 3,33)/10 278 = 3,04 g.
Totalt: 7,86 g.
Svar: 7,86 g.
12. Ved å føre klor gjennom 200 g av en 5,00% løsning av hydrogenperoksid, økte massen av løsningen med 3,9 g. Beregn massefraksjonene av stoffene i den resulterende løsningen.
Løsning:
Н2О2 + Cl2 = О2 + 2НCl
1. Finn den opprinnelige mengden H2O2 i løsningen:
n1(H2O2) = m/M(H2O2) = mP-RA ω/ M(H2O2) = 200 0,05/34 =
2. La oss ta mengden absorbert klor i løsningen som X, da nO2 = x, og økningen i massen til løsningen skyldes forskjellen i massene av absorbert klor og frigjort oksygen:
m(Cl 2) − m(O 2) = Δ m eller x M(Cl 2) − x M(O2) = Δ m;
71x − 32x = 3,9; x = 0,1 mol.
3. Regn ut mengden stoffer som er igjen i løsningen:
n2(H2O2)OKSIDERT = n(Cl2) = 0,1 mol;
n(H2O2) SOM GÅR I LØSNING = n1 − n2 = 0,294 − 0,1 = 0,194 mol;
n(HCl) = 2n(Cl2) = 0,2 mol.
4. Finn massefraksjonene av stoffer i den resulterende løsningen:
ω(H202) = n(H202) M(H202)/mP-RA = 0,194 34/203,9 100% = 3,23%;
ω(HCl) = n(HCl) M(HCl)/mP-RA = 0,2 36,5/203,9 100% = 3,58%.
Svar:ω(H202) = 3,23%;
ω(NCl) = 3,58 %.
13. Mangan(II)bromidtetrahydrat som veide 4,31 g ble oppløst i et tilstrekkelig volum vann. Klor ble ført gjennom den resulterende løsningen inntil de molare konsentrasjonene av begge saltene var like. Regn ut hvor mye klor (antall) som ble ført gjennom.
Løsning:
Mn Br2 4H2O + Cl2 = MnCl2 + Br2 + 4H2O
1. Finn startmengden av mangan (II) bromidtetrahydrat i løsning:
n(Mn Br2 · 4H2O)REKV. = m/M = 4,31/287 = 1,5 10−2 mol.
2. Likhet mellom de molare konsentrasjonene av begge saltene vil oppstå når halvparten av den opprinnelige mengden Mn Br2 · 4H2O er forbrukt. At. mengden klor som kreves kan finnes fra reaksjonsligningen:
n(Cl2) = n(MnCl2) = 0,5 n(Mn Br2 · 4H2O) ref. = 7,5·10−3mol.
V(Cl2) = n·Vm = 7,5·10−3·22,4 = 0,168 l.
Svar: 0,168 l.
14. Klor ble ført gjennom 150 ml bariumbromidløsning med en molar saltkonsentrasjon på 0,05 mol/l inntil massefraksjonene av begge saltene var like. Regn ut hvor mye klor (200C, 95 kPa) som ble ført gjennom.
Løsning:
BaBr2 + Cl2 = BaCl2 + Br2
1. Fra likheten av massefraksjonene av de dannede saltene følger likheten av massene deres.
m(BaCl2) = m(BaBr2) eller n(BaCl2) M(BaCl2) = n'(BaBr2) M(BaBr2).
2. La oss ta n(BaCl2) som X mol, og n′(BaBr2), gjenværende i løsning, for SM ·V − x = 0,15·0,05− x = 7,5·10−3−x og komponer en algebraisk ligning:
208x = (7,5 10−3−x) 297;
2,2275 = 297x +208x;
3. Finn mengden klor og dets volum:
n(Cl2) = n(BaCl2) = 0,0044 mol;
V(Cl2) = nRT/P = (0,0044 8,314 293)/95 = 0,113 l.
Svar: 113 ml.
15. En blanding av kaliumbromid og fluorid med en total masse på 100 g ble oppløst i vann; overskudd av klor ble ført gjennom den resulterende løsning. Massen av resten etter fordampning og kalsinering er 80,0 g. Beregn massefraksjonene av stoffene i den resulterende blandingen.
Løsning:
1. Etter kalsinering av reaksjonsproduktene består resten av kaliumfluorid og klorid:
2KBr + Cl2 = 2KCl + Br2
2. La oss ta mengdene KF og KBr som X Og på følgelig altså
n(KCl) = n(KBr) = y mol.
La oss lage et ligningssystem basert på likheter:
m(KF) + m(KBr) = 100
m(KF) + m(KCl) = 80
n(KF) M(KF) + n(KBr) M(KBr) = 100
n(KF) M(KF) + n(KCl) M(KCl) = 80
58x + 119y = 100 58x = 100 – 119y
58 x + 74,5y = 80 100 – 119y + 74,5y = 80
44,5y = 20; y = 0,45; x = 0,8.
3. La oss finne massene av stoffer i resten og deres massefraksjoner:
m(KF) = 58·0,8 = 46,5 g.
m(KCl) = 74,5 0,45 = 33,5 g.
ω(KF) = 46,5/80·100% = 58,1%;
ω(KCl) = 33,5/80·100 % = 41,9 %.
Svar:ω(KF) = 58,1%;
ω(КCl) = 41,9 %.
16. En blanding av natriumbromid og jodid ble behandlet med overskudd av klorvann, den resulterende løsningen ble inndampet og kalsinert. Massen til den tørre resten viste seg å være 2,363 ganger mindre enn massen til den opprinnelige blandingen. Hvor mange ganger vil massen av bunnfallet oppnådd etter å ha behandlet den samme blandingen med et overskudd av sølvnitrat være større enn massen til den opprinnelige blandingen?
Løsning:
2NaBr + HClO +HCl = 2NaCl + Br2 + H2O
2NaI + HClO +HCl = 2NaCl + I2 + H2O
1. La oss ta massen av den opprinnelige blandingen som 100 g, og mengdene av saltene NaBr og NaI som danner den som X Og på hhv. Deretter, basert på forholdet (m(NaBr) + m(NaI))/m(NaCl) = 2,363, lager vi et ligningssystem:
103x + 150y = 100
2,363·58,5(x+y) = 100
x = 0,54 mol; y = 0,18 mol.
2. La oss skrive ned den andre gruppen av reaksjoner:
NaBr + AgNO3 = AgBr↓ + NaNO3
NaI + AgNO3 = AgI↓ + NaNO3
Deretter, for å bestemme forholdet mellom massene til det dannede bunnfallet og den opprinnelige blandingen av stoffer (tatt som 100 g), gjenstår det å finne mengdene og massene av AgBr og AgI, som er lik n(NaBr) og n( NaI), dvs. henholdsvis 0,18 og 0,54 mol.
3. Finn masseforholdet:
(m(AgBr) + m(AgI))/(m(NaBr) + m(NaI)) =
(M(AgBr) x + M(AgI) y)/100 =
(188 0,18 + 235 0,54)/100 =
(126,9 + 34,67)/100 = 1,62.
Svar: 1,62 ganger.
17. En blanding av magnesiumjodid og sinkjodid ble behandlet med overskudd av bromvann, den resulterende løsningen ble inndampet og kalsinert ved 200-300°C. Massen av den tørre resten viste seg å være 1,445 ganger mindre enn massen til den opprinnelige blandingen. Hvor mange ganger vil massen av bunnfallet oppnådd etter å ha behandlet den samme blandingen med overskudd av natriumkarbonat være mindre enn massen til den opprinnelige blandingen?
Løsning:
1. La oss skrive ned begge gruppene av reaksjoner, og angi massene til den opprinnelige blandingen av stoffer og de resulterende produktene som m1, m2, m3.
(MgI2 + ZnI2)+ 2Br2 = (MgBr2 + ZnBr2)+ 2I2
(MgI2 + ZnI2)+ 2 Na2CO3 = (MgCO3 + ZnCO3)↓ + 4NaI
ml/m2 = 1,445; m1/ m3 = ?
2. La oss ta mengden salter i startblandingen som X(MgI2) og på(ZnI2), så kan mengdene av produkter fra alle reaksjoner uttrykkes som
n(MgI2) = n(MgBr2) = n(MgC03) = x mol;
n(ZnI2) = n(ZnBr2) = n(ZnCO3) = y mol.








 Om selskapet Fremmedspråkkurs ved Moscow State University
Om selskapet Fremmedspråkkurs ved Moscow State University Hvilken by og hvorfor ble den viktigste i det gamle Mesopotamia?
Hvilken by og hvorfor ble den viktigste i det gamle Mesopotamia? Hvorfor Bukhsoft Online er bedre enn et vanlig regnskapsprogram!
Hvorfor Bukhsoft Online er bedre enn et vanlig regnskapsprogram! Hvilket år er et skuddår og hvordan beregnes det
Hvilket år er et skuddår og hvordan beregnes det