Vejledning i kemi. Alkalimetaller og deres forbindelser Kaliumiodidopløsning blev behandlet med overskydende klorvand
Opgaver C 2 (2013)
Reaktioner, der bekræfter forholdet mellem forskellige klasser af uorganiske stoffer
Kobber(II)oxid blev opvarmet i en strøm af carbonmonoxid. Det resulterende stof blev brændt i en kloratmosfære.
Reaktionsproduktet blev opløst i vand.
Den resulterende opløsning blev delt i to dele. En opløsning af kaliumiodid blev tilsat til den ene del, og en opløsning af sølvnitrat blev tilsat til den anden. I begge tilfælde blev dannelsen af et bundfald observeret.
Skriv ligninger for de fire beskrevne reaktioner.
Kobbernitrat blev kalcineret, og det resulterende faste stof blev opløst i fortyndet svovlsyre. Opløsningen af det resulterende salt blev underkastet elektrolyse. Stoffet frigivet ved katoden blev opløst i koncentreret salpetersyre.
Opløsningen fortsatte med frigivelse af brun gas. Skriv ligninger for de fire beskrevne reaktioner.
Jernet blev brændt i en kloratmosfære. Det resulterende stof blev behandlet med et overskud af natriumhydroxidopløsning. Der dannedes et brunt bundfald, som blev filtreret og calcineret. Remanensen efter kalcinering blev opløst i hydrogeniodsyre.
Jernet blev brændt i klor. Det resulterende salt blev tilsat til natriumcarbonatopløsningen, og et brunt bundfald blev dannet. Dette bundfald blev filtreret og calcineret. Det resulterende stof blev opløst i hydrogeniodsyre. Skriv ligninger for de fire beskrevne reaktioner.
En opløsning af kaliumiodid blev behandlet med et overskud af klorvand, og først observeredes dannelsen af et bundfald og derefter dets fuldstændige opløsning. Den resulterende iodholdige syre blev isoleret fra opløsningen, tørret og forsigtigt opvarmet.
Det resulterende oxid reagerede med carbonmonoxid. Skriv ligningerne for de beskrevne reaktioner ned.
Chrom(III)sulfidpulver blev opløst i svovlsyre. Samtidig blev der frigivet gas, og en farvet opløsning blev dannet. Et overskud af ammoniakopløsning blev tilsat til den resulterende opløsning, og gassen blev ledt gennem blynitrat. Det resulterende sorte bundfald blev hvidt efter behandling med hydrogenperoxid.
Skriv ligningerne for de beskrevne reaktioner ned.
Aluminiumspulver blev opvarmet med svovlpulver, og det resulterende stof blev behandlet med vand.
Det resulterende bundfald blev behandlet med et overskud af en koncentreret opløsning af kaliumhydroxid, indtil det var fuldstændigt opløst. En opløsning af aluminiumchlorid blev tilsat til den resulterende opløsning, og dannelsen af et hvidt præcipitat blev igen observeret. Skriv ligningerne for de beskrevne reaktioner ned.
En blanding af kaliumnitrit og ammoniumchloridpulver blev opløst i vand, og opløsningen blev forsigtigt opvarmet. Den frigjorte gas reagerede med magnesium. Reaktionsproduktet blev tilsat til et overskud af saltsyreopløsning, og der blev ikke observeret nogen gasudvikling.
Det resulterende magnesiumsalt i opløsning blev behandlet med natriumcarbonat. Skriv ligningerne for de beskrevne reaktioner ned.
Aluminiumoxid blev smeltet sammen med natriumhydroxid.
Reaktionsproduktet blev tilsat til en opløsning af ammoniumchlorid. Den frigivne gas med en skarp lugt absorberes af svovlsyre.
Det resulterende mediumsalt blev calcineret. Skriv ligningerne for de beskrevne reaktioner ned.
|
Klor reagerede med en varm opløsning af kaliumhydroxid. Efterhånden som opløsningen afkøledes, udfældedes krystaller af Bertholletsalt. De resulterende krystaller blev tilsat til en opløsning af saltsyre. Det resulterende simple stof reagerede med metallisk jern. Reaktionsproduktet blev opvarmet med en ny portion jern. Skriv ligningerne for de beskrevne reaktioner ned. Kobber blev opløst i koncentreret salpetersyre. Et overskud af ammoniakopløsning blev tilsat til den resulterende opløsning, idet man først observerede dannelsen af et bundfald og derefter dets fuldstændige opløsning. Den resulterende opløsning blev behandlet med overskydende saltsyre. Skriv ligningerne for de beskrevne reaktioner ned. Jern blev opløst i varm koncentreret svovlsyre. Det resulterende salt blev behandlet med et overskud af natriumhydroxidopløsning. Det brune bundfald, der dannedes, blev filtreret og calcineret. Det resulterende stof blev smeltet sammen med jern. Skriv ligninger for de fire beskrevne reaktioner. 1) CuO + CO=Cu+CO 2 |
2) Cu+Cl2 = CuCl2 3) 2CuCl2 +2KI=2CuCl↓ +I2 +2KCl 4) CuCl 2 +2AgNO3 =2AgCl↓+Cu(NO 3) 2 1) Cu(NO 3) 2 2CuO+4NO 2 +O 2 |
2) CuO+2H2SO4 =CuSO4+SO2+2H2O 3) CuSO 4 + H 2 O = Cu↓ + H 2 SO 4 + O 2 (vælg 4)Cu+4HNO3 =Cu(NO3)2+2NO2+2H2O |
|
1) 2Fe + 3Cl2 = 2FeCl3 2)FeCl3 + 3NaOH = Fe(OH)3 ↓+3NaCl 4) Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O 1) 2Al+3I2 = 2AlI3 |
2) AlI3 +3NaOH= Al(OH)3 +3NaI 3)Al(OH)3 + 3HCl= AlCl3 + 3H2O 4)2AlCl3 +3Na2CO3 +3H2O=2Al(OH)3 +3CO2 +6NaCl |
2) Fe 2 O 3 +CO=Fe+CO 2 3)2Fe+6H2SO4 =Fe2(SO4)3+3SO2+6H2O 4)Fe2 (SO 4) 3 +4H2O=2Fe+H2 +3H2SO4+O2 (elektrolyse) 1) ZnS+2HNO3 =Zn(NO3)2+H2S |
|
2)2ZnS +3O2 =2ZnO +2SO2 3)2H2S+SO2=3S↓+2H2O 4)S+6HNO3 =H2SO4 +6NO2 +2H2O |
2) CuO+2H2SO4 =CuSO4+SO2+2H2O 2) FeS + 2H2O=Fe(OH)2+H2S 3)2H2S+3O22S02+2H2O 4) Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O |
1)2KI+Cl2=2KCl+I2 2)I2+5Cl2+6H2O=10HCl+2HIO3 3)2HIO3I2O5 + H2O 4) I 2 O 5 + 5CO = I 2 + 5 CO 2 |
|
1)Cr2S3+3H2SO4 =Cr2(SO4)3+3H2S 2)Cr2 (SO 4) 4 + 6NH 3 + 6H 2 O=2Cr(OH) 3 ↓+3(NH 4) 2 SO 4 3)H2S+Pb(NO3)2=PbS↓+2HNO3 4)PbS+4H2O2=PbS04+4H2O |
1)2Al+3S Al2S 3 2)Al2S3 +6H2O=2Al(OH)3 ↓+3H2S 3)Al(OH)3+KOH=K 4)3K+AlCl3 =3KCl+Al(OH)3 ↓ |
1)KNO3 +Pb KNO2 +PbO 2)2KNO2 +2H2SO4 +2KI=2K2SO4 + 2NO+I2 +2H2O 3)I2+10HNO32HIO3+10NO2+4H2O 4)10NO2 +P=2P205 +10NO |
|
1)3Cu+8HNO3 =3Cu(NO3)2+2NO+4H2O 4)(OH)2+3H2SO4 = CuSO4+2(NH4)2SO4 + 2H2O |
1)4Mg+10HNO3 = 4Mg(NO3)2 +NH4NO3 + 3H2O 2) Mg(NO 3) 2 +2KOH=Mg(OH) 2 ↓+2KNO 3 3)NH4NO3 +KOHKNO3 +NH3 +H2O 4)4NH3+3O2=2N2+6H2O |
1) KNO2 +NH4Cl KCl+N2 +2H2O 2) 3Mg+N2 =Mg3N2 3)Mg3N2+8HCl=3MgCl2+2NH4Cl 4)2MgCl 2 + 2 Na 2 CO 3 + H 2 O= (MgOH) 2 CO 3 ↓+ CO 2 + 4 NaCl |
|
1) Al 2 O 3 + 2 NaOH 2 NaAlO 2 + H 2 O 2)NaAlO2 +NH 4 Cl+H 2 O=NaCl+ Al(OH) 3 ↓+NH 3 3)2NH3+H2SO4 =(NH4)2S04 4)(NH4)2SO4NH3+NH4HS04 |
1)3Cl2 +6KOH6KCl+KClO3 +3H2O 2)6HCl+KClO3 =KCl+3Cl2 +3H2O 3)2Fe+3Cl2 =2FeCl3 4)2FeCl3 +Fe3FeCl2 |
1)3Cu+4HNO3 =3Cu(NO3)2+2NO2+4H2O 2) Cu(NO 3) 2 + 2NH 3 H 2 O=Cu(OH) 2 + 2NH 4 NO 3 3) Cu(OH)2+4NH3H2O =(OH)2+4H2O 4)(OH)2 +6HCl= CuCl2 +4NH4Cl + 2H2O |
|
19 Dokument C 2 Reaktioner, bekræfter forhold forskellige klasser uorganisk stoffer Givet vandige løsninger... Skriv ligninger for de fire mulige reaktioner. Dans stoffer: hydrogenbromidsyre, ... udfældes under reaktioner stof gul farve brændt på... Sammenfattende rapport fra formændene for fagkommissionerne i Astrakhan-regionen om akademiske emner i statens endelige certificering for uddannelsesprogrammer for sekundær almen uddannelseRapport4 21,9 40,6 C2 Reaktioner, bekræfter forhold forskellige klasser uorganisk stoffer 54,1 23,9 9,9 7,7 4,3 C3 Reaktioner, bekræfter forhold organiske forbindelser 56,8 10 ... Kalendertematisk planlægning af klasser som forberedelse til Unified State-eksamen i kemi i det akademiske år 2013-2014.Kalender og tematisk planlægning25) 27.03.2014 Reaktioner, bekræfter forhold forskellige klasser uorganisk stoffer. Løsning af øvelser C-2...simpelt stoffer. Kompleksets kemiske egenskaber stoffer. Forhold forskellige klasser uorganisk stoffer. Reaktioner ionbytning... Kalendertematisk lektionsplan for forberedelse til Unified State Exam in Kemi for skolekandidater i Barnaul og Altai-territoriet i 2015. LektionsnummerKalender-tematisk plan... (ved at bruge eksemplet med aluminium- og zinkforbindelser). Forhold uorganisk stoffer. Reaktioner, bekræfter forhold forskellige klasser uorganisk stoffer(37 (C2)). 28. februar 2015... |
Kemi underviser
LEKTION 10
10. klasse(første studieår)
Fortsættelse. For begyndelsen, se nr. 22/2005; 1, 2, 3, 5, 6, 8, 9, 11/2006
Redoxreaktioner
Plan
1. Oxidations-reduktionsreaktioner (ORR), oxidationsgrad.
2. Oxidationsproces, de vigtigste reduktionsmidler.
3. Reduktionsprocessen, de vigtigste oxidationsmidler.
4. Redox-dualitet.
5. Hovedtyper af ORR (intermolekylær, intramolekylær, disproportionation).
6. ORR værdi.
7. Metoder til kompilering af ORR-ligninger (elektronisk og elektron-ion balance).
Alle kemiske reaktioner baseret på ændringer i de involverede atomers oxidationstilstande kan opdeles i to typer: ORR (dem, der opstår med en ændring i oxidationstilstande) og ikke-ORR.
Oxidationstilstand– den betingede ladning af et atom i et molekyle, beregnet ud fra den antagelse, at der kun findes ionbindinger i molekylet.
Regler for bestemmelse af graden af oxidation
Oxidationstilstanden for atomer af simple stoffer er nul.
Summen af oxidationstilstande for atomer i et komplekst stof (i et molekyle) er nul.
Oxidationstilstanden for alkalimetalatomer er +1.
Oxidationstilstanden for jordalkalimetalatomer er +2.
Oxidationstilstanden for bor- og aluminiumatomer er +3.
Oxidationstilstanden for hydrogenatomer er +1 (i hydrider af alkali- og jordalkalimetal -1).
Oxidationstilstanden for oxygenatomer er -2 (i peroxider -1).
Enhver ORR er et sæt af processer for elektrondonation og -addition.
Processen med at afgive elektroner kaldes oxidation. Partikler (atomer, molekyler eller ioner), der donerer elektroner, kaldes restaurere. Som et resultat af oxidation øges reduktionsmidlets oxidationstilstand. Reduktionsmidler kan være partikler i lavere eller mellemliggende oxidationstilstande. De vigtigste reduktionsmidler er: alle metaller i form af simple stoffer, især aktive; C, CO, NH 3, PH 3, CH 4, SiH 4, H 2 S og sulfider, hydrogenhalogenider og metalhalogenider, metalhydrider, metalnitrider og phosphider.
Processen med at tilføje elektroner kaldes restaurering. Partikler, der accepterer elektroner, kaldes oxidationsmidler. Som et resultat af reduktion falder oxidationstilstanden af oxidationsmidlet. Oxidationsmidler kan være partikler i højere eller mellemliggende oxidationstilstande. De vigtigste oxidationsmidler: simple ikke-metaliske stoffer med høj elektronegativitet (F 2, Cl 2, O 2), kaliumpermanganat, chromater og dichromater, salpetersyre og nitrater, koncentreret svovlsyre, perchlorsyre og perchlorater.
Der er tre typer redoxreaktioner.
Intermolekylær OVR - et oxidationsmiddel og et reduktionsmiddel indgår i forskellige stoffer, for eksempel:

Intramolekylær OVR – et oxidationsmiddel og et reduktionsmiddel er en del af ét stof.

Disse kan være forskellige elementer, for eksempel:

eller et kemisk grundstof i forskellige oxidationstilstande, for eksempel: Disproportionering (autooxidation-selvhelbredende)

– oxidationsmidlet og reduktionsmidlet er det samme grundstof, som er i en mellemliggende oxidationstilstand, f.eks.

ORR'er er af stor betydning, da de fleste reaktioner, der forekommer i naturen, tilhører denne type (fotosynteseproces, forbrænding). Derudover bruges ORR'er aktivt af mennesker i deres praktiske aktiviteter (reduktion af metaller, syntese af ammoniak):
For at kompilere ORR-ligninger kan du bruge den elektroniske balance (elektroniske kredsløb) metoden eller elektron-ion balance metoden.
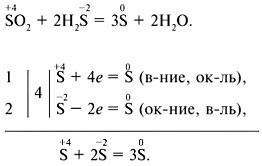
Elektronisk balancemetode:

Elektron-ion balance metode:
Test om emnet "Oxidations-reduktionsreaktioner"
1. Kaliumdichromat blev behandlet med svovldioxid i en svovlsyreopløsning og derefter med en vandig opløsning af kaliumsulfid. Det endelige stof X er:
a) kaliumchromat; b) chrom(III)oxid;
2. c) chrom(III)hydroxid; d) chrom(III)sulfid.
Hvilket reaktionsprodukt mellem kaliumpermanganat og brombrintesyre kan reagere med svovlbrinte?
a) Brom; b) mangan(II)bromid;
3. c) mangandioxid; d) kaliumhydroxid.
Oxidationen af jern(II)iodid med salpetersyre producerer jod og nitrogenmonoxid. Hvad er forholdet mellem koefficienten for oxidationsmidlet og koefficienten for reduktionsmidlet i ligningen for denne reaktion?
4. a) 4:1; b) 8:3; c) 1:1; d) 2:3.
Oxidationstilstanden af carbonatomet i bicarbonation er lig med:
5. a) +2; b) -2; c) +4; d) +5.
Kaliumpermanganat i et neutralt miljø reduceres til:
a) mangan; b) mangan(II)oxid;
6. c) mangan(IV)oxid; d) kaliummanganat.
Summen af koefficienterne i ligningen for reaktionen af mangandioxid med koncentreret saltsyre er lig med:
7. a) 14; b) 10; c) 6; d) 9.
Af de nævnte forbindelser udviser kun følgende oxidationsevne:
a) svovlsyre; b) svovlsyrling;
8. c) hydrosulfidsyre; d) kaliumsulfat.
Af de listede forbindelser udvises redox-dualitet af:
a) hydrogenperoxid; b) natriumperoxid;
9. c) natriumsulfit; d) natriumsulfid.
a) neutralisering; b) restaurering;
c) misforhold; d) udveksling.
10. Et carbonatoms oxidationstilstand falder ikke numerisk sammen med dets valens i stoffet:
a) carbontetrachlorid; b) ethan;
c) calciumcarbid; d) kulilte.
Nøglen til testen
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| V | EN | EN | V | V | G | a, d | a, b, c | b, c | b, c |
Øvelser om redoxreaktioner
(elektronisk og elektron-ion balance)
Opgave 1. Opret OVR-ligninger ved hjælp af den elektroniske balancemetode, bestem typen af OVR.
1. Zink + kaliumdichromat + svovlsyre = zinksulfat + chrom(III)sulfat + kaliumsulfat + vand.
Elektronisk balance:

2. Tin(II)sulfat + kaliumpermanganat + svovlsyre = tin(IV)sulfat + mangansulfat + kaliumsulfat + vand.
3. Natriumiodid + kaliumpermanganat + kaliumhydroxid = jod + kaliummanganat + natriumhydroxid.
4. Svovl + kaliumchlorat + vand = klor + kaliumsulfat + svovlsyre.
5. Kaliumiodid + kaliumpermanganat + svovlsyre = mangan(II)sulfat + jod + kaliumsulfat + vand.
6. Jern(II)sulfat + kaliumdichromat + svovlsyre = jern(III)sulfat + chrom(III)sulfat + kaliumsulfat + vand.
7. Ammoniumnitrat = nitrogenoxid (I) + vand.
8. Fosfor + salpetersyre = fosforsyre + nitrogenoxid (IV) + vand.
9. Salpetersyre = salpetersyre + nitrogenoxid (II) + vand.
10. Kaliumchlorat + saltsyre = klor + kaliumchlorid + vand.
11. Ammoniumdichromat = nitrogen + chrom(III)oxid + vand.
12. Kaliumhydroxid + klor = kaliumchlorid + kaliumchlorat + vand.
13. Svovl(IV)oxid + brom + vand = svovlsyre + brombrintesyre.
14. Svovl(IV)oxid + svovlbrinte = svovl + vand.
15. Natriumsulfit = natriumsulfid + natriumsulfat.
16. Kaliumpermanganat + saltsyre = mangan(II)chlorid + klor + kaliumchlorid + vand.
17. Acetylen + oxygen = kuldioxid + vand.
18. Kaliumnitrit + kaliumpermanganat + svovlsyre = kaliumnitrat + mangan(II)sulfat + kaliumsulfat + vand.
19. Silicium + kaliumhydroxid + vand = kaliumsilicat + brint.
20. Platin + salpetersyre + saltsyre = platin(IV)chlorid + nitrogenoxid + vand.
21. Arsensulfid + salpetersyre = arsensyre + svovldioxid + nitrogendioxid + vand.
22. Kaliumpermanganat = kaliummanganat + mangan(IV)oxid + oxygen.
23.
Kobber(I)sulfid + oxygen + calciumcarbonat = kobber(II)oxid + calciumsulfit +
+ kuldioxid.
24.
Jern(II)chlorid + kaliumpermanganat + saltsyre = jern(III)chlorid + chlor +
+ mangan(II)chlorid + kaliumchlorid + vand.
25. Jern(II)sulfit + kaliumpermanganat + svovlsyre = jern(III)sulfat + mangan(II)sulfat + kaliumsulfat + vand.
Svar på øvelser i opgave 1


Ved anvendelse af halvreaktionsmetoden (elektron-ion-balance) skal man huske på, at i vandige opløsninger sker bindingen af overskydende oxygen og tilsætningen af oxygen med et reduktionsmiddel forskelligt i sure, neutrale og alkaliske medier. I sure opløsninger er overskydende ilt bundet af protoner til dannelse af vandmolekyler, og i neutrale og alkaliske opløsninger af vandmolekyler til dannelse af hydroxidioner. Tilsætningen af oxygen med et reduktionsmiddel udføres i sure og neutrale miljøer på grund af vandmolekyler med dannelse af hydrogenioner og i et alkalisk miljø - på grund af hydroxidioner med dannelse af vandmolekyler.
Neutralt miljø:
Alkalisk miljø:
oxidationsmiddel + H 2 O = ... + OH – ,
reduktionsmiddel + OH – = ... + H 2 O.
Surt miljø:
oxidationsmiddel + H + = ... + H 2 O,
reduktionsmiddel + H2O = ... + H+.
Opgave 2. Ved hjælp af elektron-ion-balancemetoden komponer du ligninger for redoxreaktioner, der forekommer i et bestemt miljø.
1. Natriumsulfit + kaliumpermanganat + vand = ......................
2. Jern(II)hydroxid + ilt + vand = .....................................
3. Natriumbromid + kaliumpermanganat + vand = ..........................
4. Svovlbrinte + brom + vand = svovlsyre + .......................
5. Sølv(I)nitrat + phosphin + vand = sølv + phosphorsyre + ...................................
I ALKALINE MILJØ
1. Natriumsulfit + kaliumpermanganat + kaliumhydroxid = .......................
2. Kaliumbromid + chlor + kaliumhydroxid = kaliumbromat + ..........................
3. Mangan(II)sulfat + kaliumchlorat + kaliumhydroxid = kaliummanganat + ...................... .
4. Chrom(III)chlorid + brom + kaliumhydroxid = kaliumchromat + ...........................
5. Mangan(IV)oxid + kaliumchlorat + kaliumhydroxid = kaliummanganat + ...................... .
I et surt miljø
1. Natriumsulfit + kaliumpermanganat + svovlsyre = .......................
2. Kaliumnitrit + kaliumiodid + svovlsyre = nitrogenoxid (II) + ......................
3. Kaliumpermanganat + nitrogenoxid (II) + svovlsyre = nitrogenoxid (IV) + ...................... .
4. Kaliumiodid + kaliumbromat + saltsyre = .......................
5. Mangan(II)nitrat + bly(IV)oxid + salpetersyre = mangansyre +
+ ...................... .
Svar på øvelser i opgave 2
N E U T R A L MILJØ

Opgave 3. Brug elektron-ion-balancemetoden til at sammensætte ORR-ligninger.
1. Mangan(II)hydroxid + chlor + kaliumhydroxid = mangan(IV)oxid + ...................... .
Elektron-ion balance:

2. Mangan(IV)oxid + oxygen + kaliumhydroxid = kaliummanganat +.........................
3. Jern(II)sulfat + brom + svovlsyre = .......................
4. Kaliumiodid + jern(III)sulfat = ....................... .
5. Hydrogenbromid + kaliumpermanganat = ...................................
6. Hydrogenchlorid + chrom(VI)oxid = chrom(III)chlorid + .......................
7. Ammoniak + brom = ......................
8. Kobber(I)oxid + salpetersyre = nitrogenoxid(II) + .......................
9. Kaliumsulfid + kaliummanganat + vand = svovl + .......................
10. Nitrogenoxid (IV) + kaliumpermanganat + vand = .......................
11. Kaliumiodid + kaliumdichromat + svovlsyre = ...................................
12. Bly(II)sulfid + hydrogenperoxid = ..............................
13. Hypoklorsyre + hydrogenperoxid = saltsyre + ..........................
14. Kaliumiodid + hydrogenperoxid = ...................................
15. Kaliumpermanganat + hydrogenperoxid = mangan(IV)oxid + .....................................
16. Kaliumiodid + kaliumnitrit + eddikesyre = nitrogenoxid (II) + ............................... .
17. Kaliumpermanganat + kaliumnitrit + svovlsyre = ...................................
18. Svovlsyre + klor + vand = svovlsyre + ..........................
19. Svovlsyrling + svovlbrinte = svovl + ..............................
vanddannelse. Opløsningen opnået efter at have passeret gasser gennem vand havde en sur reaktion. Når denne opløsning blev behandlet med sølvnitrat, dannedes 14,35 g af et hvidt bundfald. Bestem den kvantitative og kvalitative sammensætning af den oprindelige blanding af gasser. Løsning.
Gassen, der brænder for at danne vand, er brint, den er let opløselig i vand. Brint med ilt og brint med klor reagerer eksplosivt i sollys. Det er tydeligt, at der var klor i blandingen med brint, pga den resulterende HC1 er meget opløselig i vand og giver et hvidt bundfald med AgN03.
Blandingen består således af gasserne H2 og C1:
1 mol 1 mol
HC1 + AgN03 -» AgCl 4- HN03.
x mol 14,35
Ved behandling af 1 mol HC1 dannes 1 mol AgCl, og ved behandling af x mol 14,35 g eller 0,1 mol. Mr(AgCl) = 108 + 2 4- 35,5 = 143,5, M(AgCl) = 143,5 g/mol,
v= - = = 0,1 mol,
x = 0,1 mol HC1 var indeholdt i opløsningen. 1 mol 1 mol 2 mol H2 4- C12 2HC1 x mol mol 0,1 mol
x = y = 0,05 mol (1,12 l) hydrogen og klor reagerede til 0,1 mol
NS1. Blandingen indeholdt 1,12 liter klor og 1,12 liter brint + 1,12 liter (overskud) = 2,24 liter.
Eksempel 6. Der er en blanding af natriumchlorid og natriumiodid i laboratoriet. 104,25 g af denne blanding blev opløst i vand, og overskydende chlor blev ledt gennem den resulterende opløsning, derefter blev opløsningen inddampet til tørhed, og remanensen blev calcineret til konstant vægt ved 300 °C.
Tørstofmassen viste sig at være 58,5 g. Bestem sammensætningen af den oprindelige blanding i procent.
Mr(NaCl) = 23 + 35,5 = 58,5, M(NaCl) = 58,5 g/mol, Mr(Nal) = 127 + 23 = 150 M(Nal) = 150 g/mol.
I den indledende blanding: masse af NaCl - x g, masse af Nal - (104,25 - x) g.
Når natriumchlorid og iodid ledes gennem en opløsning, fortrænges jod af det. Når den tørre remanens var ført igennem, fordampede jodet. Det er således kun NaCl, der kan være et tørstof.
I det resulterende stof: masse af initial NaCl x g, masse af det resulterende (58,5-x):
2 150 g 2 58,5 g
2NaI + C12 -> 2NaCl + 12
(104,25 - x) g (58,5 - x) g
2.150 (58,5 - x) = 2.58,5 (104,25-x)
x = - = 29,25 (g),
dem. NaCl i blandingen var 29,25 g, og Nal - 104,25 - 29,25 = 75 (g).
Lad os finde sammensætningen af blandingen (i procent):
w(Nal) = 100 % = 71,9 %,
©(NaCl) = 100 % - 71,9 % = 28,1 %.
Eksempel 7: 68,3 g af en blanding af nitrat, iodid og kaliumchlorid blev opløst i vand og behandlet med chlorvand. Som et resultat blev 25,4 g jod frigivet (hvis opløseligheden i vand blev forsømt). Den samme opløsning blev behandlet med sølvnitrat. 75,7 g sediment faldt. Bestem sammensætningen af den oprindelige blanding.
Klor interagerer ikke med kaliumnitrat og kaliumchlorid:
2KI + C12 -» 2KS1 + 12,
2 mol - 332 g 1 mol - 254 g
Mg(K1) = 127 + 39 - 166,
x = = 33,2 g (KI var i blandingen).
v(KI) - - = = 0,2 mol.
1 mol 1 mol
KI + AgN03 = Agl + KN03.
0,2 mol x mol
x = = 0,2 mol.
Mr(Agl) = 108 + 127 = 235,
m(Agl) = Mv = 235 0,2 = 47 (r),
så vil AgCl være
75,7 g - 47 g = 28,7 g.
74,5 g 143,5 g
KCl + AgN03 = AgCl + KN03
X = 1 L = 14,9 (KCI).
Derfor indeholdt blandingen: 68,3 - 33,2 - 14,9 = 20,2 g KN03.
Eksempel 8. For at neutralisere 34,5 g oleum forbruges 74,5 ml af en 40% opløsning af kaliumhydroxid. Hvor mange mol svovloxid (VI) er der pr. 1 mol svovlsyre?
100 % svovlsyre opløser svovloxid (VI) i alle forhold. Sammensætningen udtrykt ved formlen H2S04*xS03 kaldes oleum. Lad os beregne, hvor meget kaliumhydroxid der skal til for at neutralisere H2S04:
1 mol 2 mol
H2S04 + 2KON -> K2S04 + 2Н20 xl mol y mol
y - 2*x1 mol KOH går til at neutralisere S03 i oleum. Lad os beregne, hvor meget KOH der skal til for at neutralisere 1 mol S03:
1 mol 2 mol
S03 4- 2KOH -> K2SO4 + H20 x2 mol z mol
z - 2 x2 mol KOH går til at neutralisere SOg i oleum. 74,5 ml 40% KOH-opløsning bruges til at neutralisere oleum, dvs. 42 g eller 0,75 mol KOH.
Derfor er 2 xl + 2x 2 = 0,75,
98 xl + 80 x2 = 34,5 g,
xl = 0,25 mol H2S04,
x2 = 0,125 mol S03.
Eksempel 9 Der er en blanding af calciumcarbonat, zinksulfid og natriumchlorid. Hvis 40 g af denne blanding udsættes for overskydende saltsyre, frigives 6,72 liter gasser, som ved interaktion med overskydende svovloxid (IV) vil frigive 9,6 g sediment. Bestem sammensætningen af blandingen.
Når blandingen blev udsat for overskydende saltsyre, kunne carbonmonoxid (IV) og hydrogensulfid frigives. Kun svovlbrinte reagerer med svovl(IV)oxid, så dets volumen kan beregnes ud fra mængden af frigivet bundfald:
CaC03 + 2HC1 -> CaC12 + H20 + C02t(l)
100 g - 1 mol 22,4 l - 1 mol
ZnS + 2HC1 -> ZnCl2 + H2St (2)
97 g - 1 mol 22,4 l - 1 mol
44,8 l - 2 mol 3 mol
2H2S + S02 -» 3S + 2H20 (3)
xl l 9,6 g (0,3 mol)
xl = 4,48 l (0,2 mol) H2S; fra ligning (2 - 3) er det klart, at ZnS var 0,2 mol (19,4 g):
2H2S + S02 -> 3S + 2H20.
Det er indlysende, at carbonmonoxid (IV) i blandingen var:
6,72 l - 4,48 l = 2,24 l (C02).
Løsning:
2Cl2 + 2H2O = 4HCl + O2
mp-pa = m(H2O) + m(Cl2) - m(O2);
Am = m(Cl2) - m(O2);
Lad os tage n(Cl2) for at være X n(02) = 0,5x;
Lad os oprette en algebraisk ligning baseret på ovenstående lighed og finde X:
Am = x M(Cl2) - 0,5x M(O2) = x(71 - 16) = 55x;
x = 0,04 mol;
V(Cl2) = n(Cl2) Vm = 0,004 22,4 = 0,896 l.
Svar: 0,896 l.
10. Beregn intervallet af tilladte værdier for volumenet af klor (nr.), der er nødvendigt for fuldstændig chlorering af 10,0 g af en blanding af jern og kobber.
Løsning:
Da betingelsen ikke siger, hvad forholdet mellem metaller i blandingen er, kan vi kun antage, at intervallet af tilladte værdier for volumen af klor i dette tilfælde vil være intervallet mellem dets volumener, der kræves for at chlorere 10 g af hver metal separat. Og at løse problemet kommer ned til at finde disse mængder sekventielt.
2Fe + 3Cl2 = 2FeCl3
Cu + Cl′2 = CuCl2
n(Cl2) = 1,5n(Fe) = 1,5 10/56 = 0,26 mol;
V(Cl2) = n(Cl2) Vm = 0,26 22,4 = 5,99 ≈ 6 l;
n(Cl'2) = n(Cu) = 10/63,5 = 0,16 mol;
V(Cl′2) = 22,4 · 0,16 = 3,5 l.
Svar: 3,5 ≤ V(Cl2) ≤ 6 l.
11. Beregn massen af jod, der dannes ved behandling af en blanding af natriumiodiddihydrat, kaliumiodid og magnesiumiodid med et overskud af en forsuret opløsning af kaliumpermanganat, hvori massefraktionerne af alle salte er lige store, og den samlede mængde af alle stoffer er 50,0 mmol.
Løsning:
Lad os nedskrive ligningerne for reaktionerne i opløsningen og sammensætte de generelle halvreaktioner, på grundlag af hvilke vi vil arrangere koefficienterne:
10NaI 2H2O + 2KMnO4 + 8H2SO4 = 5I2 + 2MnSO4 + 5Na2SO4 + K2SO4 + 28H2O
10KI + 2KMnO4 + 8H2SO4 = 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
5MgI2 + 2KMnO4 + 8H2SO4 = 5I2 + 2MnSO4 + 5MgSO4 + K2SO4 + 8H2O
MnO4¯+ 8H+ + 5ē = Mn2+ + 4H2O 2
2I¯− 2 ē = I2 5
2 MnO4¯+ 16H+ + 10 I¯= 2 Mn2+ + 5I2 + 8H2O
Af ligheden af massefraktionerne af bestanddelene i blandingen følger det, at deres masser også er ens. Forveksler dem med X Lad os lave en algebraisk ligning baseret på ligheden:
n1 + n2 + n3 = 50,0 mmol
m1/M(NaI 2H2O) + m2/M(KI) + m3/M(MgI2) = 50,0 mmol
m1 = m2 = m3 = x
x/186 + x/166 + x/278 = 50 10-3 mol
m(12)1 = 5M(12) m(NaI2H20)/10M(NaI2H20) = (5 254 3,33)/10186 = 2,27 g;
m(12)2 = 5M(12) m(KI)/10M(KI) = (5 254 3,33)/10166 = 2,55 g;
m(12)3 = 5M(12) m(MgI2)/10M(MgI2) = (5 254 3,33)/10 278 = 3,04 g.
I alt: 7,86 g.
Svar: 7,86 g.
12. Når klor passeres gennem 200 g af en 5,00% opløsning af hydrogenperoxid, øges massen af opløsningen med 3,9 g. Beregn massefraktionerne af stoffer i den resulterende opløsning.
Løsning:
Н2О2 + Cl2 = О2 + 2НCl
1. Find den indledende mængde H2O2 i opløsning:
n1(H2O2) = m/M(H2O2) = mP-RA ω/M(H2O2) = 200 0,05/34 =
2. Lad os tage mængden af absorberet klor i opløsningen som X, så er nO2 = x, og stigningen i opløsningens masse skyldes forskellen i masserne af absorberet klor og frigivet oxygen:
m(Cl2) - m(O2) = Am eller x M(Cl2) - x M(O2) = Am;
71x - 32x = 3,9; x = 0,1 mol.
3. Beregn mængden af stoffer, der er tilbage i opløsningen:
n2(H2O2)OXIDERET = n(Cl2) = 0,1 mol;
n(H2O2) TILBAGE I OPLØSNING = n1 − n2 = 0,294 − 0,1 = 0,194 mol;
n(HCl) = 2n(Cl2) = 0,2 mol.
4. Find massefraktionerne af stoffer i den resulterende opløsning:
ω(H202) = n(H202) M(H202)/mP-RA = 0,194 34/203,9 100% = 3,23%;
ω(HCl) = n(HCl) M(HCl)/mP-RA = 0,2 36,5/203,9 100% = 3,58%.
Svar:ω(H2O2) = 3,23%;
ω(NCl) = 3,58%.
13. Mangan(II)bromidtetrahydrat med en vægt på 4,31 g blev opløst i et tilstrækkeligt volumen vand. Klor blev ledt gennem den resulterende opløsning, indtil de molære koncentrationer af begge salte var ens. Beregn hvor meget klor (antal) der blev ledt igennem.
Løsning:
Mn Br2 4H2O + Cl2 = MnCl2 + Br2 + 4H2O
1. Find den indledende mængde af mangan (II) bromidtetrahydrat i opløsning:
n(Mn Br2·4H2O)REKV. = m/M = 4,31/287 = 1,5 10−2 mol.
2. Lighed af de molære koncentrationer af begge salte vil forekomme, når halvdelen af den oprindelige mængde Mn Br2 · 4H2O er forbrugt. At. mængden af krævet klor kan findes ud fra reaktionsligningen:
n(Cl2) = n(MnCl2) = 0,5 n(Mn Br2 · 4H2O) ref. = 7,5·10-3 mol.
V(Cl2) = n·Vm = 7,5·10−3·22,4 = 0,168 l.
Svar: 0,168 l.
14. Klor blev ledt gennem 150 ml bariumbromidopløsning med en molær saltkoncentration på 0,05 mol/l, indtil massefraktionerne af begge salte var lige store. Beregn hvor meget klor (200C, 95 kPa) der blev ledt igennem.
Løsning:
BaBr2 + Cl2 = BaCl2 + Br2
1. Af ligheden af massefraktionerne af de dannede salte følger ligheden af deres masser.
m(BaCl2) = m(BaBr2) eller n(BaCl2) M(BaCl2) = n'(BaBr2) M(BaBr2).
2. Lad os tage n(BaCl2) som X mol, og n′(BaBr2), forbliver i opløsning, for SM ·V − x = 0,15·0,05− x = 7,5·10−3− x og komponer en algebraisk ligning:
208x = (7,5 10−3− x) 297;
2,2275 = 297x +208x;
3. Find mængden af klor og dets volumen:
n(Cl2) = n(BaCl2) = 0,0044 mol;
V(Cl2) = nRT/P = (0,0044 8,314 293)/95 = 0,113 l.
Svar: 113 ml.
15. En blanding af kaliumbromid og fluorid med en samlet masse på 100 g blev opløst i vand; overskydende chlor blev ledt gennem den resulterende opløsning. Massen af remanensen efter fordampning og kalcinering er 80,0 g. Beregn massefraktionerne af stoffer i den resulterende blanding.
Løsning:
1. Efter calcinering af reaktionsprodukterne består remanensen af kaliumfluorid og chlorid:
2KBr + Cl2 = 2KCl + Br2
2. Lad os tage mængderne af KF og KBr som X Og på i overensstemmelse hermed altså
n(KCl) = n(KBr) = y mol.
Lad os skabe et ligningssystem baseret på ligheder:
m(KF) + m(KBr) = 100
m(KF) + m(KCl) = 80
n(KF) M(KF) + n(KBr) M(KBr) = 100
n(KF) M(KF) + n(KCl) M(KCl) = 80
58x + 119y = 100 58x = 100 – 119y
58 x + 74,5 år = 80 100 – 119 år + 74,5 år = 80
44,5 år = 20; y = 0,45; x = 0,8.
3. Lad os finde massen af stoffer i resten og deres massefraktioner:
m(KF) = 58·0,8 = 46,5 g.
m(KCI) = 74,5 0,45 = 33,5 g.
ω(KF) = 46,5/80·100% = 58,1%;
ω(KCl) = 33,5/80·100% = 41,9%.
Svar:ω(KF) = 58,1%;
ω(КCl) = 41,9%.
16. En blanding af natriumbromid og iodid blev behandlet med overskydende chlorvand, den resulterende opløsning blev inddampet og kalcineret. Massen af den tørre rest viste sig at være 2.363 gange mindre end massen af den oprindelige blanding. Hvor mange gange vil massen af bundfaldet opnået efter behandling af den samme blanding med et overskud af sølvnitrat være større end massen af den oprindelige blanding?
Løsning:
2NaBr + HClO +HCl = 2NaCl + Br2 + H2O
2NaI + HClO +HCl = 2NaCl + I2 + H2O
1. Lad os tage massen af den oprindelige blanding som 100 g, og mængderne af saltene NaBr og NaI, der danner den som X Og på henholdsvis. Derefter, baseret på forholdet (m(NaBr) + m(NaI))/m(NaCl) = 2,363, skaber vi et ligningssystem:
103x + 150y = 100
2,363·58,5(x+y) = 100
x = 0,54 mol; y = 0,18 mol.
2. Lad os skrive den anden gruppe af reaktioner ned:
NaBr + AgNO3 = AgBr↓ + NaNO3
NaI + AgNO3 = AgI↓ + NaNO3
For derefter at bestemme forholdet mellem masserne af det dannede bundfald og den oprindelige blanding af stoffer (taget som 100 g), er det tilbage at finde mængderne og masserne af AgBr og AgI, som er lig med n(NaBr) og n( NaI), dvs. henholdsvis 0,18 og 0,54 mol.
3. Find masseforholdet:
(m(AgBr) + m(AgI))/(m(NaBr) + m(NaI)) =
(M(AgBr) x + M(Agl) y)/100 =
(188 0,18 + 235 0,54)/100 =
(126,9 + 34,67)/100 = 1,62.
Svar: 1,62 gange.
17. En blanding af magnesiumiodid og zinkiodid blev behandlet med overskydende bromvand, den resulterende opløsning blev inddampet og kalcineret ved 200 - 300°C. Massen af den tørre rest viste sig at være 1,445 gange mindre end massen af den oprindelige blanding. Hvor mange gange vil massen af bundfaldet opnået efter behandling af den samme blanding med overskydende natriumcarbonat være mindre end massen af den oprindelige blanding?
Løsning:
1. Lad os nedskrive begge grupper af reaktioner, der angiver masserne af den oprindelige blanding af stoffer og de resulterende produkter som m1, m2, m3.
(MgI2 + ZnI2)+ 2Br2 = (MgBr2 + ZnBr2)+ 2I2
(MgI2 + ZnI2)+ 2 Na2CO3 = (MgCO3 + ZnCO3)↓ + 4NaI
ml/m2 = 1,445; m1/m3 = ?
2. Lad os tage mængden af salte i den oprindelige blanding som X(MgI2) og på(ZnI2), så kan mængderne af produkter fra alle reaktioner udtrykkes som
n(MgI2) = n(MgBr2) = n(MgC03) = x mol;
n(ZnI2) = n(ZnBr2) = n(ZnCO3) = y mol.








 Om virksomheden Kurser i fremmedsprog ved Moscow State University
Om virksomheden Kurser i fremmedsprog ved Moscow State University Hvilken by og hvorfor blev den vigtigste i det gamle Mesopotamien?
Hvilken by og hvorfor blev den vigtigste i det gamle Mesopotamien? Hvorfor Bukhsoft Online er bedre end et almindeligt regnskabsprogram!
Hvorfor Bukhsoft Online er bedre end et almindeligt regnskabsprogram! Hvilket år er et skudår, og hvordan beregnes det
Hvilket år er et skudår, og hvordan beregnes det