Ķīmijas pasniedzēja rokasgrāmata. Sārmu metāli un to savienojumi Kālija jodīda šķīdumu apstrādāja ar hlora ūdens pārpalikumu
Uzdevumi C 2 (2013)
Reakcijas, kas apstiprina saistību starp dažādām neorganisko vielu klasēm
Vara (II) oksīds tika karsēts oglekļa monoksīda plūsmā. Iegūtā viela tika sadedzināta hlora atmosfērā.
Reakcijas produkts tika izšķīdināts ūdenī.
Iegūtais šķīdums tika sadalīts divās daļās. Vienai daļai tika pievienots kālija jodīda šķīdums, bet otrajai daļai pievienots sudraba nitrāta šķīdums. Abos gadījumos tika novērota nokrišņu veidošanās.
Uzrakstiet vienādojumus četrām aprakstītajām reakcijām.
Vara nitrāts tika kalcinēts, un iegūtā cietā viela tika izšķīdināta atšķaidītā sērskābē. Iegūtā sāls šķīdums tika pakļauts elektrolīzei. Katodā izdalītā viela tika izšķīdināta koncentrētā slāpekļskābē.
Izšķīšana notika, izdalot brūno gāzi. Uzrakstiet vienādojumus četrām aprakstītajām reakcijām.
Dzelzs tika sadedzināts hlora atmosfērā. Iegūto vielu apstrādāja ar pārāk daudz nātrija hidroksīda šķīduma. Izveidojās brūnas nogulsnes, kuras filtrēja un kalcinēja. Atlikums pēc kalcinēšanas tika izšķīdināts jodūdeņražskābē.
Dzelzs tika sadedzināts hlorā. Iegūto sāli pievienoja nātrija karbonāta šķīdumam, un izveidojās brūnas nogulsnes. Šīs nogulsnes tika filtrētas un kalcinētas. Iegūtā viela tika izšķīdināta jodūdeņražskābē. Uzrakstiet vienādojumus četrām aprakstītajām reakcijām.
Kālija jodīda šķīdumu apstrādāja ar hlora ūdens pārpalikumu, un vispirms tika novērota nogulšņu veidošanās un pēc tam tā pilnīga izšķīšana. Iegūtā jodu saturošā skābe tika izolēta no šķīduma, žāvēta un rūpīgi karsēta.
Iegūtais oksīds reaģēja ar oglekļa monoksīdu. Pierakstiet aprakstīto reakciju vienādojumus.
Hroma (III) sulfīda pulveris tika izšķīdināts sērskābē. Tajā pašā laikā izdalījās gāze un izveidojās krāsains šķīdums. Iegūtajam šķīdumam pievienoja pārāk daudz amonjaka šķīduma un gāzi izvadīja caur svina nitrātu. Iegūtās melnās nogulsnes pēc apstrādes ar ūdeņraža peroksīdu kļuva baltas.
Pierakstiet aprakstīto reakciju vienādojumus.
Alumīnija pulveri karsēja ar sēra pulveri, un iegūto vielu apstrādāja ar ūdeni.
Iegūtās nogulsnes apstrādāja ar pārāk daudz koncentrēta kālija hidroksīda šķīduma, līdz tās pilnībā izšķīda. Iegūtajam šķīdumam pievienoja alumīnija hlorīda šķīdumu un atkal novēroja baltu nogulšņu veidošanos. Pierakstiet aprakstīto reakciju vienādojumus.
Kālija nitrīta un amonija hlorīda pulveru maisījumu izšķīdināja ūdenī un šķīdumu viegli karsēja. Izdalītā gāze reaģēja ar magniju. Reakcijas produkts tika pievienots sālsskābes šķīduma pārpalikumam, un netika novērota gāzes izdalīšanās.
Iegūto magnija sāli šķīdumā apstrādāja ar nātrija karbonātu. Pierakstiet aprakstīto reakciju vienādojumus.
Alumīnija oksīds tika sakausēts ar nātrija hidroksīdu.
Reakcijas produkts tika pievienots amonija hlorīda šķīdumam. Izdalīto gāzi ar asu smaku absorbē sērskābe.
Iegūtais vidējais sāls tika kalcinēts. Pierakstiet aprakstīto reakciju vienādojumus.
|
Hlors reaģēja ar karstu kālija hidroksīda šķīdumu. Šķīdumam atdziestot, izgulsnējās Berthollet sāls kristāli. Iegūtos kristālus pievieno sālsskābes šķīdumam. Iegūtā vienkāršā viela reaģēja ar metālisku dzelzi. Reakcijas produkts tika uzkarsēts ar jaunu dzelzs porciju. Pierakstiet aprakstīto reakciju vienādojumus. Varš tika izšķīdināts koncentrētā slāpekļskābē. Iegūtajam šķīdumam pievienoja pārāk daudz amonjaka šķīduma, vispirms novērojot nogulšņu veidošanos un pēc tam pilnīgu izšķīšanu. Iegūto šķīdumu apstrādāja ar sālsskābes pārpalikumu. Pierakstiet aprakstīto reakciju vienādojumus. Dzelzs tika izšķīdināts karstā koncentrētā sērskābē. Iegūto sāli apstrādāja ar nātrija hidroksīda šķīduma pārpalikumu. Veidojušās brūnās nogulsnes tika filtrētas un kalcinētas. Iegūtā viela tika sakausēta ar dzelzi. Uzrakstiet vienādojumus četrām aprakstītajām reakcijām. 1) CuO + CO = Cu + CO 2 |
2) Cu+Cl 2 = CuCl 2 3) 2CuCl 2 +2KI=2CuCl↓ +I 2 +2KCl 4) CuCl 2 +2AgNO 3 =2AgCl↓+Cu(NO 3) 2 1) Cu(NO3)22CuO+4NO2+O2 |
2) CuO+2H2SO4 =CuSO4+SO2+2H2O 3) CuSO 4 +H 2 O=Cu↓+H 2 SO 4 +O 2 (izvēlēts 4) Cu+4HNO3 =Cu(NO3)2+2NO2+2H2O |
|
1) 2Fe + 3Cl 2 = 2FeCl 3 2)FeCl3 + 3NaOH = Fe(OH)3↓+3NaCl 4) Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O 1) 2Al+3I 2 = 2AlI 3 |
2) AlI 3 +3NaOH= Al(OH)3 +3NaI 3)Al(OH)3 + 3HCl= AlCl3 + 3H2O 4)2AlCl3 +3Na2CO3 +3H2O=2Al(OH)3 +3CO2 +6NaCl |
2) Fe 2 O 3 +CO=Fe+CO 2 3) 2Fe+6H2SO4 =Fe2(SO4)3+3SO2+6H2O 4)Fe2(SO4)3+4H2O=2Fe+H2+3H2SO4+O2 (elektrolīze) 1) ZnS+2HNO3 =Zn(NO3)2+H2S |
|
2) 2ZnS +3O 2 = 2ZnO +2SO 2 3) 2H2S+SO2=3S↓+2H2O 4) S+6HNO3 =H2SO4+6NO2+2H2O |
2) CuO+2H2SO4 =CuSO4+SO2+2H2O 2) FeS + 2H2O=Fe(OH)2+H2S 3) 2H2S+3O22SO2+2H2O 4) Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O |
1) 2KI+Cl2 =2KCl+I 2 2) I 2 + 5 Cl 2 + 6 H 2 O = 10 HCl + 2 HIO 3 3) 2HIO 3 I 2 O 5 + H 2 O 4) I 2 O 5 + 5CO = I 2 + 5CO 2 |
|
1) Cr2S3 +3H2SO4 =Cr2(SO4)3 +3H2S 2) Cr 2 (SO 4) 4 + 6NH 3 + 6H 2 O = 2Cr(OH) 3 ↓+3 (NH 4) 2 SO 4 3)H2S+Pb(NO3)2=PbS↓+2HNO3 4) PbS+4H2O2=PbSO4+4H2O |
1) 2Al+3S Al 2S 3 2) Al2S3 +6H2O=2Al(OH)3↓+3H2S 3)Al(OH)3 +KOH=K 4)3K+AlCl3 =3KCl+Al(OH)3 ↓ |
1)KNO 3 +Pb KNO 2 +PbO 2) 2KNO 2 + 2 H 2 SO 4 + 2 KI = 2 K 2 SO 4 + 2 NO + I 2 + 2 H 2 O 3) I2 +10HNO32HIO3 +10NO2 +4H2O 4)10NO 2 +P=2P 2 O 5 +10NO |
|
1) 3Cu+8HNO3 =3Cu(NO3)2+2NO+4H2O 4) (OH) 2 + 3H 2 SO 4 = CuSO 4 + 2 (NH 4) 2 SO 4 + 2H 2 O |
1) 4Mg+10HNO3 = 4Mg(NO3)2+NH4NO3+3H2O 2) Mg(NO3)2+2KOH=Mg(OH)2↓+2KNO3 3) NH 4 NO 3 + KOHKNO 3 + NH 3 + H 2 O 4) 4NH3 +3O2 =2N2 +6H2O |
1) KNO 2 + NH 4 Cl KCl + N 2 + 2H 2 O 2) 3Mg+N2 =Mg3N2 3) Mg 3 N 2 + 8 HCl = 3 MgCl 2 + 2 NH 4 Cl 4) 2MgCl 2 + 2Na 2 CO 3 + H 2 O= (MgOH) 2 CO 3 ↓+ CO 2 + 4NaCl |
|
1) Al 2 O 3 + 2 NaOH 2 NaAlO 2 + H 2 O 2)NaAlO 2 +NH 4 Cl+H 2 O=NaCl+ Al(OH) 3 ↓+NH 3 3) 2NH3 +H2SO4 =(NH4)2SO4 4) (NH 4) 2 SO 4 NH 3 + NH 4 HSO 4 |
1) 3Cl2 +6KOH6KCl+KClO3 +3H2O 2) 6HCl + KClO 3 = KCl + 3Cl 2 + 3 H 2 O 3)2Fe+3Cl2=2FeCl3 4) 2FeCl 3 + Fe3FeCl 2 |
1) 3Cu+4HNO3 =3Cu(NO3)2+2NO2+4H2O 2) Cu(NO3)2+2NH3H2O=Cu(OH)2+2NH4NO3 3) Cu(OH)2 +4NH3H2O =(OH)2 + 4H2O 4)(OH)2 +6HCl= CuCl2 +4NH4Cl + 2H2O |
|
19 Dokuments C 2 Reakcijas, apstiprinot attiecības dažādi klasēm neorganisks vielas Doti ūdens šķīdumi... Uzrakstiet vienādojumus četriem iespējamajiem reakcijas. Dans vielas: bromūdeņražskābe, ... laikā izgulsnējas reakcijas viela uzdegusi dzeltena krāsa... Astrahaņas apgabala mācību priekšmetu komisiju priekšsēdētāju kopsavilkuma ziņojums par valsts nobeiguma atestācijas mācību priekšmetiem vidējās vispārējās izglītības izglītības programmāsZiņojums4 21,9 40,6 C2 Reakcijas, apstiprinot attiecības dažādi klasēm neorganisks vielas 54,1 23,9 9,9 7,7 4,3 C3 Reakcijas, apstiprinot attiecības organiskie savienojumi 56,8 10 ... Nodarbību kalendāri tematiskais plānojums, gatavojoties vienotajam valsts eksāmenam ķīmijā 2013.–2014.mācību gadā PriekšmetsKalendārs un tematiskā plānošana25) 27.03.2014 Reakcijas, apstiprinot attiecības dažādi klasēm neorganisks vielas. Vingrinājumu C-2 risinājums...vienkāršs vielas. Kompleksa ķīmiskās īpašības vielas. Attiecības dažādi klasēm neorganisks vielas. Reakcijas jonu apmaiņa... Kalendārs-tematiskais stundu plāns sagatavošanās vienotajam valsts eksāmenam ķīmijā skolu absolventiem Barnaulā un Altaja apgabalā 2015. Nodarbības numursKalendārs-tematiskais plāns... (izmantojot alumīnija un cinka savienojumu piemēru). Attiecības neorganisks vielas. Reakcijas, apstiprinot attiecības dažādi klasēm neorganisks vielas(37 (C2)). 2015. gada 28. februāris... |
Ķīmijas pasniedzējs
10. NODARBĪBA
10. klase(pirmais studiju gads)
Turpinājums. Sākumam skatīt Nr.22/2005; 1, 2, 3, 5, 6, 8, 9, 11/2006
Redoksreakcijas
Plānot
1. Oksidācijas-reducēšanas reakcijas (ORR), oksidācijas pakāpe.
2. Oksidācijas process, svarīgākie reducētāji.
3. Reducēšanas process, svarīgākie oksidētāji.
4. Redox dualitāte.
5. Galvenie ORR veidi (starpmolekulārie, intramolekulārie, disproporcionālie).
6. ORR vērtība.
7. ORR vienādojumu sastādīšanas metodes (elektroniskais un elektronu-jonu līdzsvars).
Visas ķīmiskās reakcijas, kuru pamatā ir iesaistīto atomu oksidācijas pakāpes izmaiņas, var iedalīt divos veidos: ORR (tās, kas notiek, mainoties oksidācijas pakāpēm) un ne-ORR.
Oksidācijas stāvoklis– atoma nosacītais lādiņš molekulā, kas aprēķināts, pamatojoties uz pieņēmumu, ka molekulā pastāv tikai jonu saites.
Noteikumi oksidācijas pakāpes noteikšanai
Vienkāršu vielu atomu oksidācijas pakāpe ir nulle.
Atomu oksidācijas pakāpju summa kompleksā vielā (molekulā) ir nulle.
Sārmu metālu atomu oksidācijas pakāpe ir +1.
Sārmzemju metālu atomu oksidācijas pakāpe ir +2.
Bora un alumīnija atomu oksidācijas pakāpe ir +3.
Ūdeņraža atomu oksidācijas pakāpe ir +1 (sārmu un sārmzemju metālu hidrīdos –1).
Skābekļa atomu oksidācijas pakāpe ir –2 (peroksīdos –1).
Jebkurš ORR ir elektronu ziedošanas un pievienošanas procesu kopums.
Elektronu atteikšanās procesu sauc oksidēšanās. Tiek sauktas daļiņas (atomi, molekulas vai joni), kas ziedo elektronus restauratori. Oksidācijas rezultātā palielinās reducētāja oksidācijas pakāpe. Reducētāji var būt daļiņas ar zemāku vai vidēju oksidācijas pakāpi. Nozīmīgākie reducētāji ir: visi metāli vienkāršu vielu veidā, īpaši aktīvās; C, CO, NH 3, PH 3, CH 4, SiH 4, H 2 S un sulfīdi, ūdeņraža halogenīdi un metālu halogenīdi, metālu hidrīdi, metālu nitrīdi un fosfīdi.
Elektronu pievienošanas procesu sauc restaurācija. Daļiņas, kas pieņem elektronus, sauc oksidētāji. Reducēšanas rezultātā oksidētāja oksidācijas pakāpe samazinās. Oksidētāji var būt daļiņas augstākā vai vidējā oksidācijas pakāpē. Svarīgākie oksidētāji: vienkāršas nemetāla vielas ar augstu elektronegativitāti (F 2, Cl 2, O 2), kālija permanganāts, hromāti un dihromāti, slāpekļskābe un nitrāti, koncentrēta sērskābe, perhlorskābe un perhlorāti.
Ir trīs veidu redoksreakcijas.
Starpmolekulārā OVR - oksidētājs un reducētājs ir iekļauti dažādās vielās, piemēram:

Intramolekulāri OVR – oksidētājs un reducētājs ir vienas vielas daļa.

Tie var būt dažādi elementi, piemēram:

vai viens ķīmiskais elements dažādos oksidācijas stāvokļos, piemēram: Disproporcija (automātiskā oksidēšanās-pašdziedināšanās)

– oksidētājs un reducētājs ir viens un tas pats elements, kas ir vidējā oksidācijas stāvoklī, piemēram:

ORR ir liela nozīme, jo lielākā daļa dabā notiekošo reakciju pieder šim tipam (fotosintēzes process, sadegšana). Turklāt cilvēki ORR aktīvi izmanto savās praktiskajās darbībās (metālu samazināšana, amonjaka sintēze):
Lai sastādītu ORR vienādojumus, varat izmantot elektroniskā līdzsvara (elektroniskās shēmas) metodi vai elektronu jonu līdzsvara metodi.
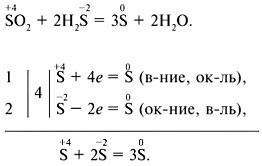
Elektroniskā bilances metode:

Elektronu jonu līdzsvara metode:
Tests par tēmu “Oksidācijas-reducēšanās reakcijas”
1. Kālija dihromātu apstrādāja ar sēra dioksīdu sērskābes šķīdumā un pēc tam ar kālija sulfīda ūdens šķīdumu. Galīgā viela X ir:
a) kālija hromāts; b) hroma(III) oksīds;
2. c) hroma(III) hidroksīds; d) hroma(III) sulfīds.
Kurš reakcijas produkts starp kālija permanganātu un bromūdeņražskābi var reaģēt ar sērūdeņradi?
a) broms; b) mangāna(II) bromīds;
3. c) mangāna dioksīds; d) kālija hidroksīds.
Dzelzs (II) jodīda oksidēšana ar slāpekļskābi rada jodu un slāpekļa monoksīdu. Kāda ir oksidētāja koeficienta attiecība pret reducētāja koeficientu šīs reakcijas vienādojumā?
4. a) 4: 1; b) 8: 3; c) 1:1; d) 2:3.
Oglekļa atoma oksidācijas pakāpe bikarbonāta jonos ir vienāda ar:
5. a) +2; b) –2; c) +4; d) +5.
Kālija permanganāts neitrālā vidē tiek samazināts līdz:
a) mangāns; b) mangāna(II) oksīds;
6. c) mangāna(IV) oksīds; d) kālija manganāts.
Koeficientu summa vienādojumā mangāna dioksīda reakcijai ar koncentrētu sālsskābi ir vienāda ar:
7. a) 14; b) 10; c) 6; d) 9.
No uzskaitītajiem savienojumiem tikai šādiem savienojumiem piemīt oksidēšanas spēja:
a) sērskābe; b) sērskābe;
8. c) hidrosulfīda skābe; d) kālija sulfāts.
No uzskaitītajiem savienojumiem redoksdualitāti demonstrē:
a) ūdeņraža peroksīds; b) nātrija peroksīds;
9. c) nātrija sulfīts; d) nātrija sulfīds.
a) neitralizācija; b) restaurācija;
c) nesamērīgums; d) apmaiņa.
10. Oglekļa atoma oksidācijas pakāpe skaitliski nesakrīt ar tā valenci vielā:
a) tetrahlorogleklis; b) etāns;
c) kalcija karbīds; d) oglekļa monoksīds.
Testa atslēga
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| V | A | A | V | V | G | a, d | a, b, c | b, c | b, c |
Vingrinājumi par redoksreakcijām
(elektroniskais un elektronu jonu līdzsvars)
Uzdevums 1. Izmantojot elektroniskā bilances metodi, izveidojiet OVR vienādojumus, nosakiet OVR veidu.
1. Cinks + kālija dihromāts + sērskābe = cinka sulfāts + hroma (III) sulfāts + kālija sulfāts + ūdens.
Elektroniskais bilance:

2. Alvas (II) sulfāts + kālija permanganāts + sērskābe = alvas (IV) sulfāts + mangāna sulfāts + kālija sulfāts + ūdens.
3. Nātrija jodīds + kālija permanganāts + kālija hidroksīds = jods + kālija manganāts + nātrija hidroksīds.
4. Sērs + kālija hlorāts + ūdens = hlors + kālija sulfāts + sērskābe.
5. Kālija jodīds + kālija permanganāts + sērskābe = mangāna(II) sulfāts + jods + kālija sulfāts + ūdens.
6. Dzelzs (II) sulfāts + kālija dihromāts + sērskābe = dzelzs (III) sulfāts + hroma (III) sulfāts + kālija sulfāts + ūdens.
7. Amonija nitrāts = slāpekļa oksīds (I) + ūdens.
8. Fosfors + slāpekļskābe = fosforskābe + slāpekļa oksīds (IV) + ūdens.
9. Slāpekļskābe = slāpekļskābe + slāpekļa oksīds (II) + ūdens.
10. Kālija hlorāts + sālsskābe = hlors + kālija hlorīds + ūdens.
11. Amonija dihromāts = slāpeklis + hroma(III) oksīds + ūdens.
12. Kālija hidroksīds + hlors = kālija hlorīds + kālija hlorāts + ūdens.
13. Sēra (IV) oksīds + broms + ūdens = sērskābe + bromūdeņražskābe.
14. Sēra(IV) oksīds + sērūdeņradis = sērs + ūdens.
15. Nātrija sulfīts = nātrija sulfīds + nātrija sulfāts.
16. Kālija permanganāts + sālsskābe = mangāna(II) hlorīds + hlors + kālija hlorīds + ūdens.
17. Acetilēns + skābeklis = oglekļa dioksīds + ūdens.
18. Kālija nitrīts + kālija permanganāts + sērskābe = kālija nitrāts + mangāna(II) sulfāts + kālija sulfāts + ūdens.
19. Silīcijs + kālija hidroksīds + ūdens = kālija silikāts + ūdeņradis.
20. Platīns + slāpekļskābe + sālsskābe = platīna(IV) hlorīds + slāpekļa oksīds + ūdens.
21. Arsēna sulfīds + slāpekļskābe = arsēnskābe + sēra dioksīds + slāpekļa dioksīds + ūdens.
22. Kālija permanganāts = kālija manganāts + mangāna(IV) oksīds + skābeklis.
23.
Vara (I) sulfīds + skābeklis + kalcija karbonāts = vara (II) oksīds + kalcija sulfīts +
+ oglekļa dioksīds.
24.
Dzelzs (II) hlorīds + kālija permanganāts + sālsskābe = dzelzs (III) hlorīds + hlors +
+ mangāna(II) hlorīds + kālija hlorīds + ūdens.
25. Dzelzs (II) sulfīts + kālija permanganāts + sērskābe = dzelzs (III) sulfāts + mangāna (II) sulfāts + kālija sulfāts + ūdens.
Atbildes uz uzdevumiem 1. uzdevumā


Lietojot pusreakcijas metodi (elektronu-jonu līdzsvaru), jāņem vērā, ka ūdens šķīdumos skābekļa pārpalikuma saistīšanās un skābekļa pievienošana ar reducētāju skābā, neitrālā un sārmainā vidē notiek atšķirīgi. Skābos šķīdumos lieko skābekli saista protoni, veidojot ūdens molekulas, bet neitrālos un sārmainos šķīdumos ar ūdens molekulām, veidojot hidroksīda jonus. Skābekļa pievienošana ar reducētāju tiek veikta skābā un neitrālā vidē ūdens molekulu dēļ, veidojot ūdeņraža jonus, un sārmainā vidē - hidroksīda jonu dēļ, veidojot ūdens molekulas.
Neitrāla vide:
Sārmaina vide:
oksidētājs + H 2 O = ... + OH – ,
reducētājs + OH – = ... + H 2 O.
Skāba vide:
oksidētājs + H + = ... + H 2 O,
reducētājs + H 2 O = ... + H + .
2. uzdevums. Izmantojot elektronu-jonu līdzsvara metodi, sastādiet vienādojumus redoksreakcijām, kas notiek noteiktā vidē.
1. Nātrija sulfīts + kālija permanganāts + ūdens = .......................
2. Dzelzs (II) hidroksīds + skābeklis + ūdens = ...................................
3. Nātrija bromīds + kālija permanganāts + ūdens = ........................
4. Sērūdeņradis + broms + ūdens = sērskābe + .......................
5. Sudraba (I) nitrāts + fosfīns + ūdens = sudrabs + fosforskābe + ..................................
SĀRMA VIDĒ
1. Nātrija sulfīts + kālija permanganāts + kālija hidroksīds = .......................
2. Kālija bromīds + hlors + kālija hidroksīds = kālija bromāts + .......................
3. Mangāna(II) sulfāts + kālija hlorāts + kālija hidroksīds = kālija manganāts + ...................... .
4. Hroma(III) hlorīds + broms + kālija hidroksīds = kālija hromāts + .......................
5. Mangāna(IV) oksīds + kālija hlorāts + kālija hidroksīds = kālija manganāts + ...................... .
Skābā vidē
1. Nātrija sulfīts + kālija permanganāts + sērskābe = .......................
2. Kālija nitrīts + kālija jodīds + sērskābe = slāpekļa oksīds (II) + .......................
3. Kālija permanganāts + slāpekļa oksīds (II) + sērskābe = slāpekļa oksīds (IV) + ...................... .
4. Kālija jodīds + kālija bromāts + sālsskābe = .......................
5. Mangāna (II) nitrāts + svina (IV) oksīds + slāpekļskābe = mangānskābe +
+ ...................... .
Atbildes uz uzdevumiem 2. uzdevumā
N E U T R A L VIDE

Uzdevums 3. Izmantojot elektronu-jonu līdzsvara metodi, izveido ORR vienādojumus.
1. Mangāna(II) hidroksīds + hlors + kālija hidroksīds = mangāna(IV) oksīds + ...................... .
Elektronu-jonu līdzsvars:

2. Mangāna(IV) oksīds + skābeklis + kālija hidroksīds = kālija manganāts +.......................
3. Dzelzs(II) sulfāts + broms + sērskābe = .......................
4. Kālija jodīds + dzelzs(III) sulfāts = ....................... .
5. Ūdeņraža bromīds + kālija permanganāts = ...................................
6. Ūdeņraža hlorīds + hroma(VI) oksīds = hroma(III) hlorīds + .......................
7. Amonjaks + broms = ......................
8. Vara(I) oksīds + slāpekļskābe = slāpekļa oksīds(II) + .......................
9. Kālija sulfīds + kālija manganāts + ūdens = sērs + .......................
10. Slāpekļa oksīds (IV) + kālija permanganāts + ūdens = .......................
11. Kālija jodīds + kālija dihromāts + sērskābe = ..................................
12. Svina(II) sulfīds + ūdeņraža peroksīds = .................................
13. Hipohlorskābe + ūdeņraža peroksīds = sālsskābe + .......................
14. Kālija jodīds + ūdeņraža peroksīds = ...................................
15. Kālija permanganāts + ūdeņraža peroksīds = mangāna(IV) oksīds + .....................................
16. Kālija jodīds + kālija nitrīts + etiķskābe = slāpekļa oksīds (II) + ................................... .
17. Kālija permanganāts + kālija nitrīts + sērskābe = ..................................
18. Sērskābe + hlors + ūdens = sērskābe + .......................
19. Sērskābe + sērūdeņradis = sērs + ...........................
ūdens veidošanās. Šķīdumam, kas iegūts pēc gāzu izlaišanas caur ūdeni, bija skāba reakcija. Šo šķīdumu apstrādājot ar sudraba nitrātu, izveidojās 14,35 g baltas nogulsnes. Noteikt sākotnējā gāzu maisījuma kvantitatīvo un kvalitatīvo sastāvu. Risinājums.
Gāze, kas sadedzina, veidojot ūdeni, ir ūdeņradis, kas nedaudz šķīst ūdenī. Ūdeņradis ar skābekli un ūdeņradis ar hloru saules gaismā reaģē sprādzienbīstami. Ir acīmredzams, ka maisījumā ar ūdeņradi bija hlors, jo iegūtais HC1 labi šķīst ūdenī un rada baltas nogulsnes ar AgN03.
Tādējādi maisījums sastāv no gāzēm H2 un C1:
1 mols 1 mols
HC1 + AgN03 -» AgCl 4- HN03.
x mol 14.35
Apstrādājot 1 molu HC1, veidojas 1 mols AgCl, apstrādājot x mol, 14,35 g jeb 0,1 mol. Mr(AgCl) = 108 + 2 4-35,5 = 143,5, M(AgCl) = 143,5 g/mol,
v= - = = 0,1 mol,
x = 0,1 mol HC1 bija šķīdumā. 1 mol 1 mol 2 mol H2 4- C12 2HC1 x mol y mol 0,1 mol
x = y = 0,05 mol (1,12 l) ūdeņraža un hlora reakcijas rezultātā izveidojās 0,1 mols
NS1. Maisījumā bija 1,12 litri hlora un 1,12 litri ūdeņraža + 1,12 litri (pārpalikums) = 2,24 litri.
6. piemērs. Laboratorijā atrodas nātrija hlorīda un nātrija jodīda maisījums. 104,25 g šī maisījuma izšķīdināja ūdenī un hlora pārpalikumu izlaida caur iegūto šķīdumu, pēc tam šķīdumu iztvaicē līdz sausumam un atlikumu kalcinēja līdz konstantam svaram 300 °C temperatūrā.
Sausās vielas masa izrādījās 58,5 g Nosakiet sākotnējā maisījuma sastāvu procentos.
Mr(NaCl) = 23 + 35,5 = 58,5, M(NaCl) = 58,5 g/mol, Mr(Nal) = 127 + 23 = 150 M(Nal) = 150 g/mol.
Sākotnējā maisījumā: NaCl masa - x g, Nal masa - (104,25 - x) g.
Kad nātrija hlorīds un jodīds tiek izlaisti caur šķīdumu, jods tiek izspiests. Kad sausais atlikums tika izlaists cauri, jods iztvaikoja. Tādējādi tikai NaCl var būt sausa viela.
Iegūtajā vielā: sākotnējā NaCl masa x g, iegūtā masa (58,5-x):
2 150 g 2 58,5 g
2NaI + C12 -> 2NaCl + 12
(104,25 - x) g (58,5 - x) g
2150 (58,5–x) = 258,5 (104,25 x)
x = - = 29,25 (g),
tie. NaCl maisījumā bija 29,25 g, un Nal - 104,25 - 29,25 = 75 (g).
Atradīsim maisījuma sastāvu (procentos):
w(Nal) = 100% = 71,9%,
©(NaCl) = 100% - 71,9% = 28,1%.
7. piemērs 68,3 g nitrāta, jodīda un kālija hlorīda maisījuma izšķīdināja ūdenī un apstrādāja ar hlora ūdeni. Rezultātā izdalījās 25,4 g joda (kura šķīdība ūdenī tika atstāta novārtā). To pašu šķīdumu apstrādāja ar sudraba nitrātu. Nokrita 75,7 g nogulumu. Nosakiet sākotnējā maisījuma sastāvu.
Hlors nesadarbojas ar kālija nitrātu un kālija hlorīdu:
2KI + C12 -» 2KS1 + 12,
2 mol - 332 g 1 mol - 254 g
Mg(K1) = 127 + 39 - 166,
x = = 33,2 g (KI bija maisījumā).
v(KI) - - = = 0,2 mol.
1 mols 1 mols
KI + AgN03 = Agl + KN03.
0,2 mol x mol
x = = 0,2 mol.
kungs (Agl) = 108 + 127 = 235,
m(Agl) = Mv = 235 0,2 = 47 (r),
tad AgCl būs
75,7 g - 47 g = 28,7 g.
74,5 g 143,5 g
KCl + AgN03 = AgCl + KN03
X = 1 L_ = 14,9 (KCl).
Tāpēc maisījums saturēja: 68,3 - 33,2 - 14,9 = 20,2 g KN03.
8. piemērs. Lai neitralizētu 34,5 g oleuma, tiek patērēti 74,5 ml 40% kālija hidroksīda šķīduma. Cik molu sēra oksīda (VI) ir uz 1 molu sērskābes?
100% sērskābe izšķīdina sēra oksīdu (VI) jebkurā proporcijā. Sastāvu, kas izteikts ar formulu H2S04*xS03, sauc par oleumu. Aprēķināsim, cik daudz kālija hidroksīda nepieciešams, lai neitralizētu H2S04:
1 mols 2 mols
H2S04 + 2KON -> K2S04 + 2Н20 xl mol y mol
y - 2*x1 mols KOH aiziet, lai neitralizētu S03 oleumā. Aprēķināsim, cik daudz KOH nepieciešams, lai neitralizētu 1 molu S03:
1 mols 2 mols
S03 4- 2KOH -> K2SO4 + H20 x2 mol z mol
z - 2 x 2 mol KOH aiziet, lai neitralizētu SOg oleumā. Oleuma neitralizēšanai izmanto 74,5 ml 40% KOH šķīduma, t.i. 42 g jeb 0,75 mol KOH.
Tāpēc 2 xl + 2x 2 = 0,75,
98 xl + 80 x2 = 34,5 g,
xl = 0,25 mol H2S04,
x2 = 0,125 mol S03.
9. piemērs Ir kalcija karbonāta, cinka sulfīda un nātrija hlorīda maisījums. Ja 40 g šī maisījuma pakļauj sālsskābes pārpalikumam, izdalīsies 6,72 litri gāzu, kuras, mijiedarbojoties ar sēra oksīda (IV) pārpalikumu, izdalīs 9,6 g nogulsnes. Nosakiet maisījuma sastāvu.
Kad maisījums tika pakļauts pārmērīgam sālsskābes iedarbībai, varēja izdalīties oglekļa monoksīds (IV) un sērūdeņradis. Tikai sērūdeņradis reaģē ar sēra (IV) oksīdu, tāpēc tā tilpumu var aprēķināt pēc izdalīto nogulšņu daudzuma:
CaC03 + 2HC1 -> CaC12 + H20 + C02t(l)
100 g - 1 mol 22,4 l - 1 mol
ZnS + 2HC1 -> ZnCl2 + H2St (2)
97 g - 1 mol 22,4 l - 1 mol
44,8 l - 2 mol 3 mol
2H2S + S02 —» 3S + 2H20 (3)
xl l 9,6 g (0,3 mol)
xl = 4,48 l (0,2 mol) H2S; no vienādojumiem (2 - 3) ir skaidrs, ka ZnS bija 0,2 moli (19,4 g):
2H2S + S02 -> 3S + 2H20.
Ir skaidrs, ka oglekļa monoksīds (IV) maisījumā bija:
6,72 l - 4,48 l = 2,24 l (C02).
Risinājums:
2Cl2 + 2H2O = 4HCl + O2
mp-pa = m(H2O) + m(Cl2) − m(O2) ;
Δm = m(Cl2) − m(O2) ;
Pieņemsim, ka n(Cl2) ir X, tad n(O2) = 0,5x;
Izveidosim algebrisko vienādojumu, pamatojoties uz iepriekš minēto vienādību un atradīsim X:
Δm = x M(Cl2) - 0,5x M(O2) = x(71 - 16) = 55x;
x = 0,04 mol;
V(Cl2) = n(Cl2) Vm = 0,004 22,4 = 0,896 l.
Atbilde: 0,896 l.
10. Aprēķiniet hlora tilpuma (nr.) pieļaujamo vērtību diapazonu, kas nepieciešams, lai pilnībā hlorētu 10,0 g dzelzs un vara maisījuma.
Risinājums:
Tā kā nosacījums nenorāda, kāda ir metālu attiecība maisījumā, mēs varam tikai pieņemt, ka hlora tilpuma pieļaujamo vērtību diapazons šajā gadījumā būs diapazons starp tā tilpumiem, kas nepieciešami, lai hlorētu 10 g katra. metāls atsevišķi. Un problēmas risināšana ir saistīta ar secīgu šo apjomu atrašanu.
2Fe + 3Cl2 = 2FeCl3
Cu + Cl′2 = CuCl2
n(Cl2) = 1,5n(Fe) = 1,5 10/56 = 0,26 mol;
V(Cl2) = n(Cl2) Vm = 0,26 22,4 = 5,99 ≈ 6 l;
n(Cl′2) = n(Cu) = 10/63,5 = 0,16 mol;
V(Cl′2) = 22,4 · 0,16 = 3,5 l.
Atbilde: 3,5 ≤ V(Cl2) ≤ 6 l.
11. Aprēķiniet joda masu, kas veidojas, apstrādājot nātrija jodīda dihidrāta, kālija jodīda un magnija jodīda maisījumu ar pārāk daudz paskābināta kālija permanganāta šķīduma, kurā visu sāļu masas daļas ir vienādas, un visu sāļu kopējo daudzumu. vielas ir 50,0 mmol.
Risinājums:
Pierakstīsim šķīdumā notiekošo reakciju vienādojumus un sastādīsim vispārējās pusreakcijas, uz kuru pamata sakārtosim koeficientus:
10NaI 2H2O + 2KMnO4 + 8H2SO4 = 5I2 + 2MnSO4 + 5Na2SO4 + K2SO4 + 28H2O
10KI + 2KMnO4 + 8H2SO4 = 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
5MgI2 + 2KMnO4 + 8H2SO4 = 5I2 + 2MnSO4 + 5MgSO4 + K2SO4 + 8H2O
MnO4¯+ 8H+ + 5ē = Mn2+ + 4H2O2
2I¯− 2 ē = I2 5
2 MnO4¯+ 16H+ + 10 I¯= 2 Mn2+ + 5I2 + 8H2O
No maisījuma sastāvdaļu masas daļu vienādības izriet, ka arī to masas ir vienādas. Sajaucot tos par X Izveidosim algebrisko vienādojumu, pamatojoties uz vienādību:
n1 + n2 + n3 = 50,0 mmol
m1/M(NaI 2H2O) + m2/M(KI) + m3/M(MgI2) = 50,0 mmol
m1 = m2 = m3 = x
x/186 + x/166 + x/278 = 50 10-3 mol
m(I2)1 = 5M(I2) m(NaI 2H2O)/10M(NaI 2H2O) = (5 254 3,33)/10 186 = 2,27 g;
m(I2)2 = 5M(I2) m(KI)/10M(KI) = (5 254 3,33)/10 166 = 2,55 g;
m(I2)3 = 5M(I2) m(MgI2)/10M(MgI2) = (5 254 3,33)/10 278 = 3,04 g.
Kopā: 7,86 g.
Atbilde: 7,86 g.
12. Izlaižot hloru caur 200 g 5,00% ūdeņraža peroksīda šķīduma, šķīduma masa palielinās par 3,9 g Aprēķina iegūtajā šķīdumā esošo vielu masas daļas.
Risinājums:
Н2О2 + Cl2 = О2 + 2НCl
1. Atrodiet sākotnējo H2O2 daudzumu šķīdumā:
n1(H2O2) = m/M(H2O2) = mP-RA ω/ M(H2O2) = 200 0,05/34 =
2. Ņemsim absorbētā hlora daudzumu šķīdumā kā X, tad nO2 = x, un šķīduma masas pieaugums ir saistīts ar absorbētā hlora un izdalītā skābekļa masu atšķirību:
m(Cl 2) − m(O 2) = Δ m vai x M(Cl 2) − x M(O2) = Δ m;
71x − 32x = 3,9; x = 0,1 mol.
3. Aprēķiniet šķīdumā atlikušo vielu daudzumu:
n2(H2O2)OKSIDĒTS = n(Cl2) = 0,1 mols;
n(H2O2) ATLIKUMS ŠĶĪDUMĀ = n1 - n2 = 0,294 - 0,1 = 0,194 mol;
n(HCl) = 2n(Cl 2) = 0,2 mol.
4. Atrodiet vielu masas daļas iegūtajā šķīdumā:
ω(H2O2) = n(H2O2) M(H2O2)/ mP-RA = 0,194 34/203,9 100% = 3,23%;
ω(HCl) = n(HCl) M(HCl)/ mP-RA = 0,2 36,5/203,9 100% = 3,58%.
Atbilde:ω(H2O2) = 3,23%;
ω(НCl) = 3,58%.
13. Mangāna (II) bromīda tetrahidrāts, kas sver 4,31 g, tika izšķīdināts pietiekamā daudzumā ūdens. Hloru izlaida caur iegūto šķīdumu, līdz abu sāļu molārās koncentrācijas bija vienādas. Aprēķiniet, cik daudz hlora (nr.) tika izvadīts cauri.
Risinājums:
Mn Br2 4H2O + Cl2 = MnCl2 + Br2 + 4H2O
1. Atrodiet sākotnējo mangāna (II) bromīda tetrahidrāta daudzumu šķīdumā:
n(Mn Br2 · 4H2O)REQ. = m/M = 4,31/287 = 1,5 10-2 mol.
2. Abu sāļu molāro koncentrāciju vienādība iestāsies, ja tiks patērēta puse no sākotnējā Mn Br2 · 4H2O daudzuma. Tas. nepieciešamo hlora daudzumu var atrast no reakcijas vienādojuma:
n(Cl2) = n(MnCl2) = 0,5 n(Mn Br2 · 4H2O) ref. = 7,5 · 10–3 mol.
V(Cl2) = n · Vm = 7,5 · 10−3 · 22,4 = 0,168 l.
Atbilde: 0,168 l.
14. Hloru izlaida cauri 150 ml bārija bromīda šķīduma ar molārās sāls koncentrāciju 0,05 mol/l, līdz abu sāļu masas daļas bija vienādas. Aprēķiniet, cik daudz hlora (200C, 95 kPa) tika izvadīts cauri.
Risinājums:
BaBr2 + Cl2 = BaCl2 + Br2
1. No izveidoto sāļu masas daļu vienādības izriet to masu vienādība.
m(BaCl2) = m(BaBr2) vai n(BaCl2) M(BaCl2) = n′(BaBr2) M(BaBr2).
2. Pieņemsim n(BaCl2) kā X mol, un n′(BaBr2), kas paliek šķīdumā, ja SM ·V − x = 0,15 · 0,05− x = 7,5 · 10−3− x, un izveidojiet algebrisko vienādojumu:
208x = (7,5 10-3-x) 297;
2,2275 = 297x +208x;
3. Atrodiet hlora daudzumu un tā tilpumu:
n(Cl2) = n(BaCl2) = 0,0044 mol;
V(Cl2) = nRT/P = (0,0044 8,314 293)/95 = 0,113 l.
Atbilde: 113 ml.
15. Kālija bromīda un fluorīda maisījums ar kopējo masu 100 g tika izšķīdināts ūdenī; hlora pārpalikums tika izvadīts caur iegūto šķīdumu. Atlikuma masa pēc iztvaicēšanas un kalcinēšanas ir 80,0 g. Aprēķina vielu masas daļas iegūtajā maisījumā.
Risinājums:
1. Pēc reakcijas produktu kalcinēšanas atlikums sastāv no kālija fluorīda un hlorīda:
2КBr + Cl2 = 2КCl + Br2
2. Ņemsim KF un KBr daudzumus kā X Un plkst attiecīgi, tad
n(KCl) = n(KBr) = y mol.
Izveidosim vienādojumu sistēmu, kuras pamatā ir vienādības:
m(KF) + m(KBr) = 100
m(KF) + m(KCl) = 80
n(KF) M(KF) + n(KBr) M(KBr) = 100
n(KF) M(KF) + n(KCl) M(KCl) = 80
58x + 119g = 100 58x = 100-119g
58 x + 74,5 g = 80 100–119 g + 74,5 g = 80
44,5 g = 20; y = 0,45; x = 0,8.
3. Atradīsim vielu masas atliekā un to masas daļas:
m(KF) = 58,0,8 = 46,5 g.
m(KCl) = 74,5 0,45 = 33,5 g.
ω(KF) = 46,5/80·100% = 58,1%;
ω(KCl) = 33,5/80 · 100% = 41,9%.
Atbilde:ω(KF) = 58,1%;
ω(КCl) = 41,9%.
16. Nātrija bromīda un jodīda maisījumu apstrādāja ar hlora ūdens pārpalikumu, iegūto šķīdumu iztvaicē un kalcinēja. Sausā atlikuma masa izrādījās 2,363 reizes mazāka par sākotnējā maisījuma masu. Cik reižu nogulšņu masa, kas iegūta pēc tā paša maisījuma apstrādes ar sudraba nitrāta pārpalikumu, būs lielāka par sākotnējā maisījuma masu?
Risinājums:
2NaBr + HClO + HCl = 2NaCl + Br2 + H2O
2NaI + HClO + HCl = 2NaCl + I2 + H2O
1. Ņemsim sākotnējā maisījuma masu 100 g, bet sāļu NaBr un NaI daudzumus, kas to veido. X Un plkst attiecīgi. Pēc tam, pamatojoties uz attiecību (m(NaBr) + m(NaI))/m(NaCl) = 2,363, mēs izveidojam vienādojumu sistēmu:
103x + 150 g = 100
2,363·58,5(x+y) = 100
x = 0,54 mol; y = 0,18 mol.
2. Pierakstīsim otro reakciju grupu:
NaBr + AgNO3 = AgBr↓ + NaNO3
NaI + AgNO3 = AgI↓ + NaNO3
Pēc tam, lai noteiktu izveidojušos nogulšņu un sākotnējā vielu maisījuma masu attiecību (ņem 100 g), atliek atrast AgBr un AgI daudzumus un masas, kas ir vienādi ar n(NaBr) un n( NaI), t.i., 0,18 un 0,54 mol.
3. Atrodiet masas attiecību:
(m(AgBr) + m(AgI))/(m(NaBr) + m(NaI)) =
(M(AgBr) x + M(AgI) y)/100 =
(188 0,18 + 235 0,54)/100 =
(126,9 + 34,67)/100 = 1,62.
Atbilde: 1,62 reizes.
17. Magnija jodīda un cinka jodīda maisījumu apstrādāja ar broma ūdens pārpalikumu, iegūto šķīdumu iztvaicē un kalcinēja 200 – 3000C temperatūrā. Sausā atlikuma masa izrādījās 1,445 reizes mazāka par sākotnējā maisījuma masu. Cik reizes nogulšņu masa, kas iegūta pēc tā paša maisījuma apstrādes ar nātrija karbonāta pārpalikumu, būs mazāka par sākotnējā maisījuma masu?
Risinājums:
1. Pierakstīsim abas reakciju grupas, apzīmējot sākotnējā vielu maisījuma un iegūto produktu masas m1, m2, m3.
(MgI2 + ZnI2) + 2Br2 = (MgBr2 + ZnBr2) + 2I2
(MgI2 + ZnI2)+ 2 Na2CO3 = (MgCO3 + ZnCO3)↓ + 4NaI
m1/ m2 = 1,445; m1/ m3 = ?
2. Ņemsim sāļu daudzumu sākotnējā maisījumā kā X(MgI2) un plkst(ZnI2), tad visu reakciju produktu daudzumus var izteikt kā
n(MgI2) = n(MgBr2) = n(MgCO3) = x mol;
n(ZnI2) = n(ZnBr2) = n(ZnCO3) = y mol.








 Par uzņēmumu Svešvalodu kursi Maskavas Valsts universitātē
Par uzņēmumu Svešvalodu kursi Maskavas Valsts universitātē Kura pilsēta un kāpēc kļuva par galveno Senajā Mezopotāmijā?
Kura pilsēta un kāpēc kļuva par galveno Senajā Mezopotāmijā? Kāpēc Bukhsoft Online ir labāka par parastu grāmatvedības programmu!
Kāpēc Bukhsoft Online ir labāka par parastu grāmatvedības programmu! Kurš gads ir garais gads un kā to aprēķināt
Kurš gads ir garais gads un kā to aprēķināt