रसायन विज्ञान ट्यूटर मैनुअल. क्षार धातुओं और उनके यौगिकों पोटेशियम आयोडाइड घोल को अतिरिक्त क्लोरीन पानी से उपचारित किया गया
कार्य सी 2 (2013)
अकार्बनिक पदार्थों के विभिन्न वर्गों के बीच संबंध की पुष्टि करने वाली प्रतिक्रियाएं
कॉपर (II) ऑक्साइड को कार्बन मोनोऑक्साइड की धारा में गर्म किया गया। परिणामी पदार्थ को क्लोरीन वातावरण में जला दिया गया। प्रतिक्रिया उत्पाद पानी में घुल गया था। परिणामी घोल को दो भागों में विभाजित किया गया। एक हिस्से में पोटैशियम आयोडाइड का घोल और दूसरे हिस्से में सिल्वर नाइट्रेट का घोल मिलाया गया। दोनों ही मामलों में, अवक्षेप का निर्माण देखा गया। वर्णित चार प्रतिक्रियाओं के लिए समीकरण लिखें।
कॉपर नाइट्रेट को कैल्सीन किया गया, और परिणामी ठोस को तनु सल्फ्यूरिक एसिड में घोल दिया गया। परिणामी नमक के घोल को इलेक्ट्रोलिसिस के अधीन किया गया। कैथोड पर छोड़ा गया पदार्थ सांद्र नाइट्रिक एसिड में घुल गया। ब्राउन गैस के निकलने के साथ विघटन आगे बढ़ा। वर्णित चार प्रतिक्रियाओं के लिए समीकरण लिखें।
लोहे को क्लोरीन के वातावरण में जलाया गया। परिणामी पदार्थ को सोडियम हाइड्रॉक्साइड घोल की अधिकता से उपचारित किया गया। एक भूरे रंग का अवक्षेप बना, जिसे छानकर शांत किया गया। कैल्सीनेशन के बाद अवशेष को हाइड्रोआयोडिक एसिड में घोल दिया गया। वर्णित चार प्रतिक्रियाओं के लिए समीकरण लिखें।
एल्युमीनियम धातु पाउडर को ठोस आयोडीन के साथ मिलाया गया और पानी की कुछ बूँदें डाली गईं। अवक्षेप बनने तक परिणामी नमक में सोडियम हाइड्रॉक्साइड का घोल मिलाया गया। परिणामी अवक्षेप को हाइड्रोक्लोरिक एसिड में घोल दिया गया। बाद में सोडियम कार्बोनेट घोल मिलाने पर फिर से वर्षा देखी गई। वर्णित चार प्रतिक्रियाओं के लिए समीकरण लिखें।
कोयले के अधूरे दहन के परिणामस्वरूप, एक गैस प्राप्त हुई, जिसके प्रवाह में आयरन (III) ऑक्साइड को गर्म किया गया। परिणामी पदार्थ को गर्म सांद्र सल्फ्यूरिक एसिड में घोल दिया गया। परिणामी नमक घोल को इलेक्ट्रोलिसिस के अधीन किया गया। वर्णित चार प्रतिक्रियाओं के लिए समीकरण लिखें।
जिंक सल्फाइड की एक निश्चित मात्रा को दो भागों में विभाजित किया गया। उनमें से एक को नाइट्रिक एसिड से उपचारित किया गया और दूसरे को हवा में फायर किया गया। जब छोड़ी गई गैसें परस्पर क्रिया करती हैं, तो एक साधारण पदार्थ का निर्माण होता है। इस पदार्थ को सांद्र नाइट्रिक एसिड के साथ गर्म किया गया और एक भूरे रंग की गैस निकली। वर्णित चार प्रतिक्रियाओं के लिए समीकरण लिखें।
सल्फर को लोहे के साथ मिश्रित किया गया था। प्रतिक्रिया उत्पाद पानी में घुल गया था। छोड़ी गई गैस अतिरिक्त ऑक्सीजन में जल गई। दहन उत्पादों को आयरन (III) सल्फेट के जलीय घोल द्वारा अवशोषित किया गया था। वर्णित चार प्रतिक्रियाओं के लिए समीकरण लिखें।
लोहे को क्लोरीन में जलाया गया। परिणामी नमक को सोडियम कार्बोनेट घोल में मिलाया गया और एक भूरे रंग का अवक्षेप बन गया। इस अवक्षेप को फ़िल्टर और कैलक्लाइंड किया गया। परिणामी पदार्थ हाइड्रोआयोडिक एसिड में घुल गया था। वर्णित चार प्रतिक्रियाओं के लिए समीकरण लिखें।
पोटेशियम आयोडाइड के एक घोल को क्लोरीन पानी की अधिकता के साथ उपचारित किया गया, और पहले एक अवक्षेप का निर्माण देखा गया, और फिर इसका पूर्ण विघटन देखा गया। परिणामी आयोडीन युक्त एसिड को घोल से अलग किया गया, सुखाया गया और सावधानीपूर्वक गर्म किया गया। परिणामी ऑक्साइड ने कार्बन मोनोऑक्साइड के साथ प्रतिक्रिया की। वर्णित प्रतिक्रियाओं के लिए समीकरण लिखिए।
क्रोमियम (III) सल्फाइड पाउडर को सल्फ्यूरिक एसिड में घोल दिया गया था। उसी समय, गैस निकली और एक रंगीन घोल बन गया। परिणामी घोल में अतिरिक्त अमोनिया घोल मिलाया गया और गैस को लेड नाइट्रेट से गुजारा गया। परिणामी काला अवक्षेप हाइड्रोजन पेरोक्साइड से उपचार के बाद सफेद हो गया। वर्णित प्रतिक्रियाओं के लिए समीकरण लिखिए।
एल्यूमीनियम पाउडर को सल्फर पाउडर के साथ गर्म किया गया और परिणामी पदार्थ को पानी से उपचारित किया गया। परिणामी अवक्षेप को पोटेशियम हाइड्रॉक्साइड के अधिक संकेंद्रित घोल से तब तक उपचारित किया गया जब तक कि यह पूरी तरह से घुल न जाए। परिणामी घोल में एल्यूमीनियम क्लोराइड का एक घोल मिलाया गया और एक सफेद अवक्षेप का निर्माण फिर से देखा गया। वर्णित प्रतिक्रियाओं के लिए समीकरण लिखिए।
प्रतिक्रिया बंद होने तक पोटेशियम नाइट्रेट को पाउडर सीसे के साथ गर्म किया गया। उत्पादों के मिश्रण को पानी से उपचारित किया गया और फिर परिणामी घोल को फ़िल्टर किया गया। निस्पंद को सल्फ्यूरिक एसिड के साथ अम्लीकृत किया गया और पोटेशियम आयोडाइड के साथ इलाज किया गया। अलग किए गए सरल पदार्थ को सांद्र नाइट्रिक एसिड के साथ गर्म किया गया। परिणामी भूरी गैस के वातावरण में लाल फास्फोरस को जलाया गया। वर्णित प्रतिक्रियाओं के लिए समीकरण लिखिए।
तांबे को तनु नाइट्रिक एसिड में घोला गया था। परिणामी घोल में अमोनिया घोल की अधिकता मिलाई गई, पहले एक अवक्षेप के गठन को देखा गया, और फिर एक गहरे नीले घोल के निर्माण के साथ इसका पूर्ण विघटन हुआ। परिणामी घोल को सल्फ्यूरिक एसिड से उपचारित किया गया जब तक कि तांबे के लवण का विशिष्ट नीला रंग दिखाई न दे। वर्णित प्रतिक्रियाओं के लिए समीकरण लिखिए।
मैग्नीशियम तनु नाइट्रिक एसिड में घुल गया था, और कोई गैस विकास नहीं देखा गया था। परिणामी घोल को गर्म करते समय अतिरिक्त पोटेशियम हाइड्रॉक्साइड घोल से उपचारित किया गया। निकली गैस को ऑक्सीजन में जलाया गया। वर्णित प्रतिक्रियाओं के लिए समीकरण लिखिए।
पोटेशियम नाइट्राइट और अमोनियम क्लोराइड पाउडर के मिश्रण को पानी में घोला गया और घोल को धीरे से गर्म किया गया। जारी गैस मैग्नीशियम के साथ प्रतिक्रिया करती है। प्रतिक्रिया उत्पाद को हाइड्रोक्लोरिक एसिड समाधान की अधिकता में जोड़ा गया था, और कोई गैस विकास नहीं देखा गया था। घोल में परिणामी मैग्नीशियम नमक को सोडियम कार्बोनेट के साथ उपचारित किया गया। वर्णित प्रतिक्रियाओं के लिए समीकरण लिखिए।
एल्युमीनियम ऑक्साइड को सोडियम हाइड्रॉक्साइड के साथ संलयन किया गया। प्रतिक्रिया उत्पाद को अमोनियम क्लोराइड के घोल में मिलाया गया था। तीखी गंध वाली निकलने वाली गैस सल्फ्यूरिक एसिड द्वारा अवशोषित कर ली जाती है। परिणामी मध्यम नमक को कैलक्लाइंड किया गया। वर्णित प्रतिक्रियाओं के लिए समीकरण लिखिए।
क्लोरीन ने पोटेशियम हाइड्रॉक्साइड के गर्म घोल के साथ प्रतिक्रिया की। जैसे ही घोल ठंडा हुआ, बर्थोलेट नमक के क्रिस्टल अवक्षेपित हो गए। परिणामी क्रिस्टल को हाइड्रोक्लोरिक एसिड के घोल में मिलाया गया। परिणामी सरल पदार्थ धात्विक लोहे के साथ प्रतिक्रिया करता है। प्रतिक्रिया उत्पाद को लोहे के एक नए हिस्से के साथ गर्म किया गया। वर्णित प्रतिक्रियाओं के लिए समीकरण लिखिए।
कॉपर को सांद्र नाइट्रिक एसिड में घोला गया था। परिणामी घोल में अमोनिया घोल की अधिकता मिलाई गई, जिससे पहले अवक्षेप का निर्माण हुआ और फिर उसका पूर्ण विघटन हुआ। परिणामी घोल को अतिरिक्त हाइड्रोक्लोरिक एसिड से उपचारित किया गया। वर्णित प्रतिक्रियाओं के लिए समीकरण लिखिए।
लोहे को गर्म सांद्र सल्फ्यूरिक एसिड में घोला गया। परिणामी नमक को सोडियम हाइड्रॉक्साइड घोल की अधिकता से उपचारित किया गया। बनने वाले भूरे अवक्षेप को फ़िल्टर किया गया और शांत किया गया। परिणामी पदार्थ को लोहे के साथ मिला दिया गया। वर्णित चार प्रतिक्रियाओं के लिए समीकरण लिखें।
|
1)CuO + CO=Cu+CO 2 2) Cu+Cl 2 = CuCl 2 3) 2CuCl 2 +2KI=2CuCl↓ +I 2 +2KCl 4) CuCl 2 +2AgNO 3 =2AgCl↓+Cu(NO 3) 2 |
1)Cu(NO 3) 2 2CuO+4NO 2 +O 2 2) CuO+2H 2 SO 4 =CuSO 4 +SO 2 +2H 2 O 3)CuSO 4 +H 2 O=Cu↓+H 2 SO 4 +O 2 (चुनें 4)Cu+4HNO 3 =Cu(NO 3) 2 +2NO 2 +2H 2 O |
1) 2Fe + 3Cl 2 = 2FeCl 3 2)FeCl 3 + 3NaOH = Fe(OH) 3 ↓+3NaCl 4)Fe 2 O 3 + 6HI = 2FeI 2 + I 2 + 3H 2 O |
|
1) 2Al+3I 2 = 2AlI 3 2) अली3 +3NaOH= अल(OH) 3 +3NaI 3)Al(OH) 3 + 3HCl= AlCl 3 + 3H 2 O 4)2AlCl 3 +3Na 2 CO 3 +3H 2 O=2Al(OH) 3 +3CO 2 +6NaCl |
2) Fe 2 O 3 +CO=Fe+CO 2 3)2Fe+6H 2 SO 4 =Fe 2 (SO 4) 3 +3SO 2 +6H 2 O 4)Fe 2 (SO 4) 3 +4H 2 O=2Fe+H 2 +3H 2 SO 4 +O 2 (इलेक्ट्रोलिसिस) |
1) ZnS+2HNO 3 =Zn(NO 3) 2 +H 2 S 2)2ZnS +3O 2 =2ZnO +2SO 2 3)2H 2 S+SO 2 =3S↓+2H 2 O 4)S+6HNO 3 =H 2 SO 4 +6NO 2 +2H 2 O |
|
2) FeS + 2H 2 O=Fe(OH) 2 +H 2 S 3)2H 2 S+3O 2 2SO 2 +2H 2 O 4)Fe 2 (SO 4) 3 +SO 2 +2H 2 O=2FeSO 4 + 2H 2 SO 4 |
1) 2Fe + 3Cl 2 = 2FeCl 3 2)2FeCl 3 +3Na 2 CO 3 =2Fe(OH) 3 +6NaCl+3CO 2 3) 2Fe(OH) 3 Fe 2 O 3 + 3H 2 O 4) Fe 2 O 3 + 6HI = 2FeI 2 + I 2 + 3H 2 O |
1)2KI+Cl 2 =2KCl+I 2 2)I 2 +5Cl 2 +6H 2 O=10HCl+2HIO 3 3)2एचआईओ 3 आई 2 ओ 5 + एच 2 ओ 4) आई 2 ओ 5 +5सीओ = आई 2 +5सीओ 2 |
|
1)सीआर 2 एस 3 +3एच 2 एसओ 4 =सीआर 2 (एसओ 4) 3 +3एच 2 एस 2)Cr 2 (SO 4) 4 +6NH 3 +6H 2 O=2Cr(OH) 3 ↓+3(NH 4) 2 SO 4 3)H 2 S+Pb(NO 3) 2 =PbS↓+2HNO 3 4)PbS+4H 2 O 2 =PbSO 4 +4H 2 O |
1)2Al+3S Al 2 S 3 2)Al 2 S 3 +6H 2 O=2Al(OH) 3 ↓+3H 2 S 3)Al(OH) 3 +KOH=K 4)3K+AlCl 3 =3KCl+Al(OH) 3 ↓ |
1)केएनओ 3 +पीबी केएनओ 2 +पीबीओ 2)2KNO 2 +2H 2 SO 4 +2KI=2K 2 SO 4 + 2NO+I 2 +2H 2 O 3)I 2 +10HNO 3 2HIO 3 +10NO 2 +4H 2 O 4)10NO 2 +P=2P 2 O 5 +10NO |
|
1)3Cu+8HNO 3 =3Cu(NO 3) 2 +2NO+4H 2 O 4)(OH) 2 +3H 2 SO 4 = CuSO 4 +2(NH 4) 2 SO 4 + 2H 2 O |
1)4Mg+10HNO3 = 4Mg(NO3)2 +NH4NO3 + 3H2O 2) Mg(NO 3) 2 +2KOH=Mg(OH) 2 ↓+2KNO 3 3)एनएच 4 नंबर 3 +कोहनो 3 +एनएच 3 +एच 2 ओ 4)4एनएच 3 +3ओ 2 =2एन 2 +6एच 2 ओ |
1)केएनओ 2 + एनएच 4 सीएल केसीएल + एन 2 + 2 एच 2 ओ 2) 3एमजी+एन 2 =एमजी 3 एन 2 3)एमजी 3 एन 2 +8एचसीएल=3एमजीसीएल 2 +2एनएच 4 सीएल 4)2MgCl 2 +2Na 2 CO 3 +H 2 O= (MgOH) 2 CO 3 ↓+ CO 2 +4NaCl |
|
1)Al 2 O 3 +2NaOH 2NaAlO 2 +H 2 O 2)NaAlO 2 +NH 4 Cl+H 2 O=NaCl+ Al(OH) 3 ↓+NH 3 3)2एनएच 3 +एच 2 एसओ 4 =(एनएच 4) 2 एसओ 4 4)(एनएच 4) 2 एसओ 4 एनएच 3 +एनएच 4 एचएसओ 4 |
1)3Cl 2 +6KOH6KCl+KClO 3 +3H 2 O 2)6HCl+KClO 3 =KCl+3Cl 2 +3H 2 O 3)2Fe+3Cl 2 =2FeCl 3 4)2FeCl 3 +Fe3FeCl 2 |
1)3Cu+4HNO 3 =3Cu(NO 3) 2 +2NO 2 +4H 2 O 2)Cu(NO 3) 2 +2NH 3 H 2 O=Cu(OH) 2 + 2NH 4 NO 3 3)Cu(OH) 2 +4NH 3 H 2 O =(OH) 2 + 4H 2 O 4)(OH) 2 +6HCl= CuCl 2 +4NH 4 सीएल + 2H 2 O |
|
19 दस्तावेज़ सी 2 प्रतिक्रियाओं, इस बात की पुष्टि संबंध विभिन्न कक्षाओं अकार्बनिक पदार्थोंदिए गए जलीय घोल... चार संभावित के लिए समीकरण लिखें प्रतिक्रिया. दिया जाता है पदार्थों: हाइड्रोब्रोमिक एसिड, ... के दौरान अवक्षेपित होता है प्रतिक्रिया पदार्थपीला रंग जल गया... माध्यमिक सामान्य शिक्षा के शैक्षिक कार्यक्रमों के लिए राज्य के अंतिम प्रमाणीकरण के शैक्षणिक विषयों पर अस्त्रखान क्षेत्र के विषय आयोगों के अध्यक्षों की सारांश रिपोर्टप्रतिवेदन4 21.9 40.6 सी2 प्रतिक्रियाओं, इस बात की पुष्टि संबंध विभिन्न कक्षाओं अकार्बनिक पदार्थों 54.1 23.9 9.9 7.7 4.3 सी3 प्रतिक्रियाओं, इस बात की पुष्टि संबंधकार्बनिक यौगिक 56.8 10 ... 2013-2014 शैक्षणिक वर्ष में रसायन विज्ञान में एकीकृत राज्य परीक्षा की तैयारी में कक्षाओं की कैलेंडर-विषयगत योजना विषयकैलेंडर और विषयगत योजना25) 27.03.2014 प्रतिक्रियाओं, इस बात की पुष्टि संबंध विभिन्न कक्षाओं अकार्बनिक पदार्थों. अभ्यास का समाधान C-2...सरल पदार्थों. कॉम्प्लेक्स के रासायनिक गुण पदार्थों. संबंध विभिन्न कक्षाओं अकार्बनिक पदार्थों. प्रतिक्रियाओंआयन विनिमय... 2015 में बरनौल और अल्ताई क्षेत्र में स्कूल स्नातकों के लिए रसायन विज्ञान में एकीकृत राज्य परीक्षा की तैयारी के लिए कैलेंडर-विषयगत पाठ योजना। पाठ संख्याकैलेंडर-विषयगत योजना... (एल्यूमीनियम और जस्ता यौगिकों के उदाहरण का उपयोग करके)। संबंध अकार्बनिक पदार्थों. प्रतिक्रियाओं, इस बात की पुष्टि संबंध विभिन्न कक्षाओं अकार्बनिक पदार्थों(37(सी2)). 28 फ़रवरी 2015... |
रसायन शास्त्र शिक्षक
पाठ 10
10 वीं कक्षा(अध्ययन का प्रथम वर्ष)
निरंतरता. शुरुआत के लिए, संख्या 22/2005 देखें; 1, 2, 3, 5, 6, 8, 9, 11/2006
रेडॉक्स प्रतिक्रियाएं
योजना
1. ऑक्सीकरण-कमी प्रतिक्रियाएं (ओआरआर), ऑक्सीकरण की डिग्री।
2. ऑक्सीकरण प्रक्रिया, सबसे महत्वपूर्ण कम करने वाले एजेंट।
3. कमी प्रक्रिया, सबसे महत्वपूर्ण ऑक्सीकरण एजेंट।
4. रिडॉक्स द्वैत।
5. ओआरआर के मुख्य प्रकार (इंटरमॉलिक्यूलर, इंट्रामोल्युलर, डिसप्रोपोर्शनेशन)।
6. ओआरआर मूल्य।
7. ओआरआर समीकरण (इलेक्ट्रॉनिक और इलेक्ट्रॉन-आयन संतुलन) संकलित करने की विधियाँ।
शामिल परमाणुओं की ऑक्सीकरण अवस्था में परिवर्तन के आधार पर सभी रासायनिक प्रतिक्रियाओं को दो प्रकारों में विभाजित किया जा सकता है: ओआरआर (वे जो ऑक्सीकरण अवस्था में परिवर्तन के साथ होते हैं) और गैर-ओआरआर।
ऑक्सीकरण अवस्था- एक अणु में एक परमाणु का सशर्त आवेश, इस धारणा के आधार पर गणना की जाती है कि अणु में केवल आयनिक बंधन मौजूद हैं।
ऑक्सीकरण की डिग्री निर्धारित करने के नियम
सरल पदार्थों के परमाणुओं की ऑक्सीकरण अवस्था शून्य होती है।
किसी जटिल पदार्थ (एक अणु में) में परमाणुओं की ऑक्सीकरण अवस्थाओं का योग शून्य के बराबर होता है।
क्षार धातु परमाणुओं की ऑक्सीकरण अवस्था +1 होती है।
क्षारीय पृथ्वी धातु परमाणुओं की ऑक्सीकरण अवस्था +2 है।
बोरॉन और एल्यूमीनियम परमाणुओं की ऑक्सीकरण अवस्था +3 है।
हाइड्रोजन परमाणुओं की ऑक्सीकरण अवस्था +1 है (क्षार और क्षारीय पृथ्वी धातुओं के हाइड्राइड में -1)।
ऑक्सीजन परमाणुओं की ऑक्सीकरण अवस्था -2 (पेरोक्साइड -1 में) है।
कोई भी ओआरआर इलेक्ट्रॉन दान और जोड़ की प्रक्रियाओं का एक समूह है।
इलेक्ट्रॉन त्यागने की प्रक्रिया कहलाती है ऑक्सीकरण.कण (परमाणु, अणु या आयन) जो इलेक्ट्रॉन दान करते हैं, कहलाते हैं पुनर्स्थापक।ऑक्सीकरण के परिणामस्वरूप, कम करने वाले एजेंट की ऑक्सीकरण अवस्था बढ़ जाती है। कम करने वाले एजेंट निम्न या मध्यवर्ती ऑक्सीकरण अवस्था वाले कण हो सकते हैं। सबसे महत्वपूर्ण कम करने वाले एजेंट हैं: सरल पदार्थों के रूप में सभी धातुएं, विशेष रूप से सक्रिय धातुएं; सी, सीओ, एनएच 3, पीएच 3, सीएच 4, सीएच 4, एच 2 एस और सल्फाइड, हाइड्रोजन हैलाइड और मेटल हैलाइड, मेटल हाइड्राइड, मेटल नाइट्राइड और फॉस्फाइड।
इलेक्ट्रॉन जोड़ने की प्रक्रिया कहलाती है पुनर्स्थापन.वे कण जो इलेक्ट्रॉन ग्रहण करते हैं, कहलाते हैं ऑक्सीडाइज़िंग एजेंट।कमी के परिणामस्वरूप, ऑक्सीकरण एजेंट की ऑक्सीकरण अवस्था कम हो जाती है। ऑक्सीकरण एजेंट उच्च या मध्यवर्ती ऑक्सीकरण अवस्था वाले कण हो सकते हैं। सबसे महत्वपूर्ण ऑक्सीकरण एजेंट: उच्च इलेक्ट्रोनगेटिविटी (एफ 2, सीएल 2, ओ 2), पोटेशियम परमैंगनेट, क्रोमेट्स और डाइक्रोमेट्स, नाइट्रिक एसिड और नाइट्रेट्स, केंद्रित सल्फ्यूरिक एसिड, पर्क्लोरिक एसिड और पर्क्लोरेट्स वाले सरल गैर-धातु पदार्थ।
रेडॉक्स प्रतिक्रियाएं तीन प्रकार की होती हैं।
आणविकओवीआर - एक ऑक्सीकरण एजेंट और एक कम करने वाला एजेंट विभिन्न पदार्थों में शामिल हैं, उदाहरण के लिए:

इंट्रामोलीक्युलरओ.वी.आर - एक ऑक्सीकरण एजेंट और एक कम करने वाला एजेंट एक ही पदार्थ का हिस्सा हैं। ये अलग-अलग तत्व हो सकते हैं, उदाहरण के लिए:

या विभिन्न ऑक्सीकरण अवस्थाओं में एक रासायनिक तत्व, उदाहरण के लिए:

अनुपातहीनता (ऑटो-ऑक्सीकरण-स्वयं-उपचार)- ऑक्सीकरण एजेंट और कम करने वाला एजेंट एक ही तत्व हैं, जो मध्यवर्ती ऑक्सीकरण अवस्था में हैं, उदाहरण के लिए:

ओआरआर का बहुत महत्व है, क्योंकि प्रकृति में होने वाली अधिकांश प्रतिक्रियाएं इसी प्रकार (प्रकाश संश्लेषण प्रक्रिया, दहन) से संबंधित हैं। इसके अलावा, ओआरआर का उपयोग मनुष्यों द्वारा उनकी व्यावहारिक गतिविधियों (धातुओं की कमी, अमोनिया के संश्लेषण) में सक्रिय रूप से किया जाता है:

ओआरआर समीकरणों को संकलित करने के लिए, आप इलेक्ट्रॉनिक संतुलन (इलेक्ट्रॉनिक सर्किट) विधि या इलेक्ट्रॉन-आयन संतुलन विधि का उपयोग कर सकते हैं।
इलेक्ट्रॉनिक संतुलन विधि:
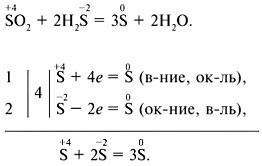
इलेक्ट्रॉन-आयन संतुलन विधि:

"ऑक्सीकरण-कमी प्रतिक्रियाएं" विषय पर परीक्षण
1. पोटेशियम डाइक्रोमेट को सल्फ्यूरिक एसिड के घोल में सल्फर डाइऑक्साइड के साथ और फिर पोटेशियम सल्फाइड के जलीय घोल के साथ उपचारित किया गया। अंतिम पदार्थ X है:
ए) पोटेशियम क्रोमेट; बी) क्रोमियम (III) ऑक्साइड;
सी) क्रोमियम (III) हाइड्रॉक्साइड; डी) क्रोमियम (III) सल्फाइड।
2. पोटेशियम परमैंगनेट और हाइड्रोब्रोमिक एसिड के बीच कौन सा प्रतिक्रिया उत्पाद हाइड्रोजन सल्फाइड के साथ प्रतिक्रिया कर सकता है?
ए) ब्रोमीन; बी) मैंगनीज (द्वितीय) ब्रोमाइड;
ग) मैंगनीज डाइऑक्साइड; घ) पोटेशियम हाइड्रॉक्साइड।
3. नाइट्रिक एसिड के साथ आयरन (II) आयोडाइड का ऑक्सीकरण आयोडीन और नाइट्रोजन मोनोऑक्साइड का उत्पादन करता है। इस प्रतिक्रिया के समीकरण में ऑक्सीकरण एजेंट के गुणांक का कम करने वाले एजेंट के गुणांक का अनुपात क्या है?
ए) 4:1; बी) 8:3; 11 बजे; घ) 2:3.
4. बाइकार्बोनेट आयन में कार्बन परमाणु की ऑक्सीकरण अवस्था बराबर होती है:
ए) +2; बी)-2; ग) +4; घ) +5.
5. तटस्थ वातावरण में पोटेशियम परमैंगनेट कम हो जाता है:
ए) मैंगनीज; बी) मैंगनीज (द्वितीय) ऑक्साइड;
ग) मैंगनीज (IV) ऑक्साइड; घ) पोटेशियम मैंगनेट।
6. सांद्र हाइड्रोक्लोरिक एसिड के साथ मैंगनीज डाइऑक्साइड की प्रतिक्रिया के समीकरण में गुणांकों का योग बराबर है:
ए) 14; बी) 10; 6 पर; घ) 9.
7. सूचीबद्ध यौगिकों में से, केवल निम्नलिखित ऑक्सीकरण क्षमता प्रदर्शित करते हैं:
ए) सल्फ्यूरिक एसिड; बी) सल्फ्यूरस एसिड;
ग) हाइड्रोसल्फाइड एसिड; घ) पोटेशियम सल्फेट।
8. सूचीबद्ध यौगिकों में से, रेडॉक्स द्वैत प्रदर्शित होता है:
ए) हाइड्रोजन पेरोक्साइड; बी) सोडियम पेरोक्साइड;
ग) सोडियम सल्फाइट; घ) सोडियम सल्फाइड।
9. निम्नलिखित प्रकार की प्रतिक्रियाओं में से, रेडॉक्स प्रतिक्रियाएं हैं:
क) निराकरण; बी) बहाली;
ग) अनुपातहीनता; घ) विनिमय।
10. कार्बन परमाणु की ऑक्सीकरण अवस्था संख्यात्मक रूप से पदार्थ में उसकी संयोजकता से मेल नहीं खाती:
ए) कार्बन टेट्राक्लोराइड; बी) इथेन;
ग) कैल्शियम कार्बाइड; घ) कार्बन मोनोऑक्साइड।
परीक्षण की कुंजी
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| वी | ए | ए | वी | वी | जी | ए, डी | ए बी सी | बी, सी | बी, सी |
रेडॉक्स प्रतिक्रियाओं पर व्यायाम
(इलेक्ट्रॉनिक और इलेक्ट्रॉन-आयन संतुलन)
कार्य 1. इलेक्ट्रॉनिक संतुलन विधि का उपयोग करके ओवीआर समीकरण बनाएं, ओवीआर का प्रकार निर्धारित करें।
1. जिंक + पोटेशियम डाइक्रोमेट + सल्फ्यूरिक एसिड = जिंक सल्फेट + क्रोमियम (III) सल्फेट + पोटेशियम सल्फेट + पानी।
इलेक्ट्रॉनिक संतुलन:

2. टिन(II) सल्फेट + पोटेशियम परमैंगनेट + सल्फ्यूरिक एसिड = टिन(IV) सल्फेट + मैंगनीज सल्फेट + पोटेशियम सल्फेट + पानी।
3. सोडियम आयोडाइड + पोटेशियम परमैंगनेट + पोटेशियम हाइड्रॉक्साइड = आयोडीन + पोटेशियम मैंगनेट + सोडियम हाइड्रॉक्साइड।
4. सल्फर + पोटेशियम क्लोरेट + पानी = क्लोरीन + पोटेशियम सल्फेट + सल्फ्यूरिक एसिड।
5. पोटेशियम आयोडाइड + पोटेशियम परमैंगनेट + सल्फ्यूरिक एसिड = मैंगनीज (II) सल्फेट + आयोडीन + पोटेशियम सल्फेट + पानी।
6. आयरन (II) सल्फेट + पोटेशियम डाइक्रोमेट + सल्फ्यूरिक एसिड = आयरन (III) सल्फेट + क्रोमियम (III) सल्फेट + पोटेशियम सल्फेट + पानी।
7. अमोनियम नाइट्रेट = नाइट्रिक ऑक्साइड (I) + पानी।
8. फॉस्फोरस + नाइट्रिक एसिड = फॉस्फोरिक एसिड + नाइट्रिक ऑक्साइड (IV) + पानी।
9. नाइट्रस अम्ल = नाइट्रिक अम्ल + नाइट्रिक ऑक्साइड (II) + जल।
10. पोटेशियम क्लोरेट + हाइड्रोक्लोरिक एसिड = क्लोरीन + पोटेशियम क्लोराइड + पानी।
11. अमोनियम डाइक्रोमेट = नाइट्रोजन + क्रोमियम (III) ऑक्साइड + पानी।
12. पोटेशियम हाइड्रॉक्साइड + क्लोरीन = पोटेशियम क्लोराइड + पोटेशियम क्लोरेट + पानी।
13. सल्फर(IV) ऑक्साइड + ब्रोमीन + पानी = सल्फ्यूरिक एसिड + हाइड्रोब्रोमिक एसिड।
14. सल्फर(IV) ऑक्साइड + हाइड्रोजन सल्फाइड = सल्फर + पानी।
15. सोडियम सल्फाइट = सोडियम सल्फाइड + सोडियम सल्फेट।
16. पोटेशियम परमैंगनेट + हाइड्रोक्लोरिक एसिड = मैंगनीज (II) क्लोराइड + क्लोरीन + पोटेशियम क्लोराइड + पानी।
17. एसिटिलीन + ऑक्सीजन = कार्बन डाइऑक्साइड + पानी।
18. पोटेशियम नाइट्राइट + पोटेशियम परमैंगनेट + सल्फ्यूरिक एसिड = पोटेशियम नाइट्रेट + मैंगनीज (II) सल्फेट + पोटेशियम सल्फेट + पानी।
19. सिलिकॉन + पोटेशियम हाइड्रॉक्साइड + पानी = पोटेशियम सिलिकेट + हाइड्रोजन।
20. प्लैटिनम + नाइट्रिक एसिड + हाइड्रोक्लोरिक एसिड = प्लैटिनम (IV) क्लोराइड + नाइट्रिक ऑक्साइड + पानी।
21. आर्सेनिक सल्फाइड + नाइट्रिक एसिड = आर्सेनिक एसिड + सल्फर डाइऑक्साइड + नाइट्रोजन डाइऑक्साइड + पानी।
22. पोटेशियम परमैंगनेट = पोटेशियम मैंगनीज + मैंगनीज (IV) ऑक्साइड + ऑक्सीजन।
23.
कॉपर(I) सल्फाइड + ऑक्सीजन + कैल्शियम कार्बोनेट = कॉपर(II) ऑक्साइड + कैल्शियम सल्फाइट +
+ कार्बन डाइऑक्साइड.
24.
आयरन (II) क्लोराइड + पोटेशियम परमैंगनेट + हाइड्रोक्लोरिक एसिड = आयरन (III) क्लोराइड + क्लोरीन +
+ मैंगनीज (II) क्लोराइड + पोटेशियम क्लोराइड + पानी।
25. आयरन (II) सल्फाइट + पोटेशियम परमैंगनेट + सल्फ्यूरिक एसिड = आयरन (III) सल्फेट + मैंगनीज (II) सल्फेट + पोटेशियम सल्फेट + पानी।
कार्य 1 में अभ्यास के उत्तर


अर्ध-प्रतिक्रिया विधि (इलेक्ट्रॉन-आयन संतुलन) का उपयोग करते समय, यह ध्यान में रखा जाना चाहिए कि जलीय घोल में अतिरिक्त ऑक्सीजन का बंधन और कम करने वाले एजेंट द्वारा ऑक्सीजन का जोड़ अम्लीय, तटस्थ और क्षारीय मीडिया में अलग-अलग होता है। अम्लीय समाधानों में, अतिरिक्त ऑक्सीजन पानी के अणुओं को बनाने के लिए प्रोटॉन द्वारा बाध्य होती है, और तटस्थ और क्षारीय समाधानों में पानी के अणुओं द्वारा हाइड्रॉक्साइड आयन बनाने के लिए बाध्य होती है। कम करने वाले एजेंट द्वारा ऑक्सीजन का समावेश अम्लीय और तटस्थ वातावरण में पानी के अणुओं के कारण हाइड्रोजन आयनों के निर्माण के साथ होता है, और क्षारीय वातावरण में - हाइड्रॉक्साइड आयनों के कारण पानी के अणुओं के निर्माण के कारण होता है।
तटस्थ वातावरण:
क्षारीय वातावरण:
ऑक्सीकरण एजेंट + एच 2 ओ = ... + ओएच - ,
कम करने वाला एजेंट + OH – = ... + H 2 O.
अम्लीय वातावरण:
ऑक्सीकरण एजेंट + एच + = ... + एच 2 ओ,
कम करने वाला एजेंट + एच 2 ओ = ... + एच +।
कार्य 2.इलेक्ट्रॉन-आयन संतुलन विधि का उपयोग करके, एक निश्चित वातावरण में होने वाली रेडॉक्स प्रतिक्रियाओं के लिए समीकरण बनाएं।
1. सोडियम सल्फाइट + पोटेशियम परमैंगनेट + पानी = .......................
2. आयरन (II) हाइड्रॉक्साइड + ऑक्सीजन + पानी = ………………………
3. सोडियम ब्रोमाइड + पोटेशियम परमैंगनेट + पानी = ..................................
4. हाइड्रोजन सल्फाइड + ब्रोमीन + पानी = सल्फ्यूरिक एसिड + .......................
5. सिल्वर(I) नाइट्रेट + फॉस्फीन + पानी = सिल्वर + फॉस्फोरिक एसिड + ..................................
क्षारीय वातावरण में
1. सोडियम सल्फाइट + पोटेशियम परमैंगनेट + पोटेशियम हाइड्रॉक्साइड = .......................
2. पोटेशियम ब्रोमाइड + क्लोरीन + पोटेशियम हाइड्रॉक्साइड = पोटेशियम ब्रोमेट + .......................
3. मैंगनीज (II) सल्फेट + पोटेशियम क्लोरेट + पोटेशियम हाइड्रॉक्साइड = पोटेशियम मैंगनेट + ....................... .
4. क्रोमियम (III) क्लोराइड + ब्रोमीन + पोटेशियम हाइड्रॉक्साइड = पोटेशियम क्रोमेट + .......................
5. मैंगनीज (IV) ऑक्साइड + पोटेशियम क्लोरेट + पोटेशियम हाइड्रॉक्साइड = पोटेशियम मैंगनेट + ………………।
अम्लीय वातावरण में
1. सोडियम सल्फाइट + पोटेशियम परमैंगनेट + सल्फ्यूरिक एसिड = .......................
2. पोटेशियम नाइट्राइट + पोटेशियम आयोडाइड + सल्फ्यूरिक एसिड = नाइट्रिक ऑक्साइड (II) + .......................
3. पोटेशियम परमैंगनेट + नाइट्रिक ऑक्साइड (II) + सल्फ्यूरिक एसिड = नाइट्रिक ऑक्साइड (IV) + ………………।
4. पोटेशियम आयोडाइड + पोटेशियम ब्रोमेट + हाइड्रोक्लोरिक एसिड = .......................
5. मैंगनीज(II) नाइट्रेट + लेड(IV) ऑक्साइड + नाइट्रिक एसिड = मैंगनीज एसिड +
+ ...................... .
कार्य 2 में अभ्यास के उत्तर
एन ई यू टी आर ए एल पर्यावरण

कार्य 3. इलेक्ट्रॉन-आयन संतुलन विधि का उपयोग करके ओआरआर समीकरण बनाएं।
1. मैंगनीज(II) हाइड्रॉक्साइड + क्लोरीन + पोटेशियम हाइड्रॉक्साइड = मैंगनीज(IV) ऑक्साइड + ……………….
इलेक्ट्रॉन-आयन संतुलन:

2. मैंगनीज (IV) ऑक्साइड + ऑक्सीजन + पोटेशियम हाइड्रॉक्साइड = पोटेशियम मैंगनीज + .......................
3. आयरन (II) सल्फेट + ब्रोमीन + सल्फ्यूरिक एसिड = .......................
4. पोटेशियम आयोडाइड + आयरन (III) सल्फेट = ....................... .
5. हाइड्रोजन ब्रोमाइड + पोटेशियम परमैंगनेट = ..................................
6. हाइड्रोजन क्लोराइड + क्रोमियम (VI) ऑक्साइड = क्रोमियम (III) क्लोराइड + .......................
7. अमोनिया + ब्रोमीन = .......................
8. कॉपर (I) ऑक्साइड + नाइट्रिक एसिड = नाइट्रिक ऑक्साइड (II) + .......................
9. पोटेशियम सल्फाइड + पोटेशियम मैंगनेट + पानी = सल्फर + .......................
10. नाइट्रिक ऑक्साइड (IV) + पोटेशियम परमैंगनेट + पानी = .......................
11. पोटेशियम आयोडाइड + पोटेशियम डाइक्रोमेट + सल्फ्यूरिक एसिड = ..................................
12. लेड(II) सल्फाइड + हाइड्रोजन पेरोक्साइड = .......................................
13. हाइपोक्लोरस एसिड + हाइड्रोजन पेरोक्साइड = हाइड्रोक्लोरिक एसिड + .......................
14. पोटेशियम आयोडाइड + हाइड्रोजन पेरोक्साइड = ..................................
15. पोटेशियम परमैंगनेट + हाइड्रोजन पेरोक्साइड = मैंगनीज (IV) ऑक्साइड + ...................................
16. पोटेशियम आयोडाइड + पोटेशियम नाइट्राइट + एसिटिक एसिड = नाइट्रिक ऑक्साइड (II) + …………………………।
17. पोटेशियम परमैंगनेट + पोटेशियम नाइट्राइट + सल्फ्यूरिक एसिड = ..................................
18. सल्फ्यूरस अम्ल + क्लोरीन + पानी = सल्फ्यूरिक अम्ल + .......................
19. सल्फ्यूरस अम्ल + हाइड्रोजन सल्फाइड = सल्फर + ...............................
जल निर्माण. पानी के माध्यम से गैसों को प्रवाहित करने के बाद प्राप्त घोल में अम्लीय प्रतिक्रिया होती है। जब इस घोल को सिल्वर नाइट्रेट से उपचारित किया गया तो 14.35 ग्राम सफेद अवक्षेप बना। गैसों के प्रारंभिक मिश्रण की मात्रात्मक और गुणात्मक संरचना निर्धारित करें। समाधान।
जो गैस जलकर पानी बनाती है वह हाइड्रोजन है, यह पानी में थोड़ा घुलनशील है। सूर्य के प्रकाश में हाइड्रोजन ऑक्सीजन के साथ और हाइड्रोजन क्लोरीन के साथ विस्फोटक रूप से प्रतिक्रिया करता है। यह स्पष्ट है कि हाइड्रोजन के साथ मिश्रण में क्लोरीन था, क्योंकि परिणामी HC1 पानी में अत्यधिक घुलनशील है और AgN03 के साथ एक सफेद अवक्षेप देता है।
इस प्रकार, मिश्रण में गैसें H2 और C1 शामिल हैं:
1 मोल 1 मोल
HC1 + AgN03 -» AgCl 4- HN03.
x मोल 14.35
HC1 के 1 mol का उपचार करने पर, AgCl का 1 mol बनता है, और x mol का उपचार करने पर 14.35 g या 0.1 mol बनता है। श्री(एजीसीएल) = 108 + 2 4- 35.5 = 143.5, एम(एजीसीएल) = 143.5 ग्राम/मोल,
v= - = = 0.1 मोल,
घोल में x = 0.1 mol HC1 मौजूद था। 1 मोल 1 मोल 2 मोल H2 4- C12 2HC1 x मोल y मोल 0.1 मोल
x = y = 0.05 mol (1.12 l) हाइड्रोजन और क्लोरीन ने प्रतिक्रिया करके 0.1 mol बनाया
एनएस1. मिश्रण में 1.12 लीटर क्लोरीन और 1.12 लीटर हाइड्रोजन + 1.12 लीटर (अतिरिक्त) = 2.24 लीटर था।
उदाहरण 6. प्रयोगशाला में सोडियम क्लोराइड और सोडियम आयोडाइड का मिश्रण है। इस मिश्रण का 104.25 ग्राम पानी में घोल दिया गया था और अतिरिक्त क्लोरीन को परिणामी घोल में प्रवाहित किया गया था, फिर घोल को सूखने के लिए वाष्पित किया गया था और अवशेषों को 300 डिग्री सेल्सियस पर स्थिर वजन पर कैलक्लाइंड किया गया था।
शुष्क पदार्थ का द्रव्यमान 58.5 ग्राम निकला। प्रारंभिक मिश्रण की संरचना प्रतिशत के रूप में निर्धारित करें।
मिस्टर(NaCl) = 23 + 35.5 = 58.5, M(NaCl) = 58.5 g/mol, मिस्टर(Nal) = 127 + 23 = 150 M(Nal) = 150 g/mol।
प्रारंभिक मिश्रण में: NaCl का द्रव्यमान - x g, Nal का द्रव्यमान - (104.25 - x) g।
जब सोडियम क्लोराइड और आयोडाइड को एक घोल से गुजारा जाता है, तो आयोडीन विस्थापित हो जाता है। जब सूखा अवशेष पारित किया गया, तो आयोडीन वाष्पित हो गया। इस प्रकार, केवल NaCl ही शुष्क पदार्थ हो सकता है।
परिणामी पदार्थ में: प्रारंभिक NaCl x g का द्रव्यमान, परिणामी का द्रव्यमान (58.5-x):
2 150 ग्राम 2 58.5 ग्राम
2NaI + C12 -> 2NaCl + 12
(104.25 - एक्स) जी (58.5 - एक्स) जी
2,150 (58.5 - x) = 2,58.5 (104.25-x)
एक्स = - = 29.25 (जी),
वे। मिश्रण में NaCl 29.25 ग्राम था, और Nal - 104.25 - 29.25 = 75 (g)।
आइए मिश्रण की संरचना ज्ञात करें (प्रतिशत में):
डब्ल्यू(नाल) = 100% = 71.9%,
©(NaCl) = 100% - 71.9% = 28.1%।
उदाहरण 7: नाइट्रेट, आयोडाइड और पोटेशियम क्लोराइड के मिश्रण का 68.3 ग्राम पानी में घोला गया और क्लोरीन पानी से उपचारित किया गया। परिणामस्वरूप, 25.4 ग्राम आयोडीन जारी हुआ (जिसकी पानी में घुलनशीलता की उपेक्षा की गई)। उसी घोल को सिल्वर नाइट्रेट से उपचारित किया गया। 75.7 ग्राम तलछट गिरी। प्रारंभिक मिश्रण की संरचना निर्धारित करें.
क्लोरीन पोटेशियम नाइट्रेट और पोटेशियम क्लोराइड के साथ परस्पर क्रिया नहीं करता है:
2KI + C12 -» 2KS1 + 12,
2 मोल - 332 ग्राम 1 मोल - 254 ग्राम
एमजी(के1) = 127 + 39 - 166,
x = = 33.2 ग्राम (मिश्रण में KI था)।
v(KI) - - = 0.2 मोल।
1 मोल 1 मोल
KI + AgN03 = Agl + KN03।
0.2 मोल x मोल
एक्स = = 0.2 मोल.
श्री(एजीएल) = 108 + 127 = 235,
एम(एजीएल) = एमवी = 235 0.2 = 47 (आर),
तो AgCl होगा
75.7 ग्राम - 47 ग्राम = 28.7 ग्राम.
74.5 ग्राम 143.5 ग्राम
KCl + AgN03 = AgCl + KN03
एक्स = 1 एल_ = 14.9 (केसीएल)।
इसलिए, मिश्रण में शामिल हैं: 68.3 - 33.2 - 14.9 = 20.2 ग्राम KN03।
उदाहरण 8. 34.5 ग्राम ओलियम को बेअसर करने के लिए, पोटेशियम हाइड्रॉक्साइड के 40% घोल के 74.5 मिलीलीटर की खपत होती है। प्रति 1 मोल सल्फ्यूरिक एसिड में कितने मोल सल्फर ऑक्साइड (VI) होते हैं?
100% सल्फ्यूरिक एसिड किसी भी अनुपात में सल्फर ऑक्साइड (VI) को घोल देता है। सूत्र H2S04*xS03 द्वारा व्यक्त रचना को ओलियम कहा जाता है। आइए गणना करें कि H2S04 को बेअसर करने के लिए कितने पोटेशियम हाइड्रॉक्साइड की आवश्यकता है:
1 मोल 2 मोल
H2S04 + 2KON -> K2S04 + 2Н20 xl mol y mol
y - KOH का 2*x1 मोल ओलियम में S03 को उदासीन करने के लिए जाता है। आइए गणना करें कि S03 के 1 मोल को बेअसर करने के लिए कितने KOH की आवश्यकता है:
1 मोल 2 मोल
S03 4- 2KOH -> K2SO4 + H20 x2 mol z mol
z - 2 x2 mol KOH ओलियम में SOg को उदासीन करने के लिए जाता है। ओलियम को निष्क्रिय करने के लिए 40% KOH घोल के 74.5 मिलीलीटर का उपयोग किया जाता है, अर्थात। 42 ग्राम या 0.75 मोल KOH.
इसलिए, 2 xl + 2x 2 = 0.75,
98 xl + 80 x2 = 34.5 ग्राम,
एक्सएल = 0.25 मोल एच2एस04,
x2 = 0.125 मोल S03.
उदाहरण 9 कैल्शियम कार्बोनेट, जिंक सल्फाइड और सोडियम क्लोराइड का मिश्रण है। यदि इस मिश्रण का 40 ग्राम अतिरिक्त हाइड्रोक्लोरिक एसिड के संपर्क में आता है, तो 6.72 लीटर गैसें निकलेंगी, जो अतिरिक्त सल्फर ऑक्साइड (IV) के साथ बातचीत करने पर 9.6 ग्राम तलछट छोड़ेंगी। मिश्रण की संरचना निर्धारित करें.
जब मिश्रण अतिरिक्त हाइड्रोक्लोरिक एसिड के संपर्क में आया, तो कार्बन मोनोऑक्साइड (IV) और हाइड्रोजन सल्फाइड निकल सकता था। केवल हाइड्रोजन सल्फाइड सल्फर (IV) ऑक्साइड के साथ प्रतिक्रिया करता है, इसलिए इसकी मात्रा की गणना जारी अवक्षेप की मात्रा से की जा सकती है:
CaC03 + 2HC1 -> CaC12 + H20 + C02t(l)
100 ग्राम - 1 मोल 22.4 लीटर - 1 मोल
ZnS + 2HC1 -> ZnCl2 + H2St (2)
97 ग्राम - 1 मोल 22.4 लीटर - 1 मोल
44.8 लीटर - 2 मोल 3 मोल
2H2S + S02 -» 3S + 2H20 (3)
एक्सएल एल 9.6 ग्राम (0.3 मोल)
एक्सएल = 4.48 एल (0.2 मोल) एच2एस; समीकरण (2-3) से यह स्पष्ट है कि ZnS 0.2 मोल (19.4 ग्राम) था:
2H2S + S02 -> 3S + 2H20.
यह स्पष्ट है कि मिश्रण में कार्बन मोनोऑक्साइड (IV) था:
6.72 लीटर - 4.48 लीटर = 2.24 लीटर (C02)।
समाधान:
2Cl2 + 2H2O = 4HCl + O2
एमपी-पीए = एम(एच2ओ) + एम(सीएल2) - एम(ओ2) ;
Δm = m(Cl2) - m(O2) ;
आइए हम n(Cl2) को लें एक्स, तो n(O2) = 0.5x;
आइए उपरोक्त समानता के आधार पर एक बीजगणितीय समीकरण बनाएं और खोजें एक्स:
Δm = x M(Cl2) - 0.5x M(O2) = x(71 - 16) = 55x;
एक्स = 0.04 मोल;
वी(सीएल2) = एन(सीएल2) वीएम = 0.004 22.4 = 0.896 एल।
उत्तर: 0.896 एल.
10. लोहे और तांबे के मिश्रण के 10.0 ग्राम के पूर्ण क्लोरीनीकरण के लिए आवश्यक क्लोरीन की मात्रा (संख्या) के अनुमेय मूल्यों की सीमा की गणना करें।
समाधान:
चूंकि शर्त यह नहीं बताती है कि मिश्रण में धातुओं का अनुपात क्या है, हम केवल यह मान सकते हैं कि इस मामले में क्लोरीन की मात्रा के लिए अनुमेय मूल्यों की सीमा प्रत्येक के 10 ग्राम को क्लोरीन करने के लिए आवश्यक मात्राओं के बीच की सीमा होगी। धातु अलग से. और समस्या का समाधान इन संस्करणों को क्रमिक रूप से खोजने पर निर्भर करता है।
2Fe + 3Cl2 = 2FeCl3
Cu + Cl′2 = CuCl2
n(Cl2) = 1.5n(Fe) = 1.5 · 10/56 = 0.26 mol;
वी(सीएल2) = एन(सीएल2) वीएम = 0.26 22.4 = 5.99 ≈ 6 एल;
n(Cl′2) = n(Cu) = 10/63.5 = 0.16 mol;
वी(सीएल′2) = 22.4 · 0.16 = 3.5 लीटर।
उत्तर: 3.5 ≤ वी(सीएल2) ≤ 6 एल।
11. सोडियम आयोडाइड डाइहाइड्रेट, पोटेशियम आयोडाइड और मैग्नीशियम आयोडाइड के मिश्रण को पोटेशियम परमैंगनेट के अम्लीय घोल की अधिकता के साथ उपचारित करने पर बनने वाले आयोडीन के द्रव्यमान की गणना करें, जिसमें सभी लवणों का द्रव्यमान अंश बराबर होता है, और सभी की कुल मात्रा पदार्थ 50.0 mmol है।
समाधान:
आइए समाधान में होने वाली प्रतिक्रियाओं के समीकरण लिखें और सामान्य अर्ध-प्रतिक्रियाएं बनाएं, जिसके आधार पर हम गुणांकों की व्यवस्था करेंगे:
10NaI 2H2O + 2KMnO4 + 8H2SO4 = 5I2 + 2MnSO4 + 5Na2SO4 + K2SO4 + 28H2O
10KI + 2KMnO4 + 8H2SO4 = 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
5MgI2 + 2KMnO4 + 8H2SO4 = 5I2 + 2MnSO4 + 5MgSO4 + K2SO4 + 8H2O
MnO4¯+ 8H+ + 5ē = Mn2+ + 4H2O 2
2I¯− 2 ē = I2 5
2 MnO4¯+ 16H+ + 10 I¯= 2 Mn2+ + 5I2 + 8H2O
मिश्रण के घटकों के द्रव्यमान अंशों की समानता से यह निष्कर्ष निकलता है कि उनका द्रव्यमान भी बराबर है। उन्हें गलत समझकर एक्सआइए समानता के आधार पर एक बीजगणितीय समीकरण बनाएं:
n1 + n2 + n3 = 50.0 mmol
m1/M(NaI 2H2O) + m2/M(KI) + m3/M(MgI2) = 50.0 mmol
एम1 = एम2 = एम3 = एक्स
x/186 + x/166 + x/278 = 50 10-3 मोल
m (I2)1 = 5M(I2) m(NaI 2H2O)/10M(NaI 2H2O) = (5 254 3.33)/10 186 = 2.27 ग्राम;
एम (आई2)2 = 5एम(आई2) एम(केआई)/10एम(केआई) = (5 254 3.33)/10 166 = 2.55 ग्राम;
m (I2)3 = 5M(I2) m(MgI2)/10M(MgI2) = (5 254 3.33)/10 278 = 3.04 ग्राम।
कुल: 7.86 ग्राम.
उत्तर: 7.86 ग्राम.
12. हाइड्रोजन पेरोक्साइड के 5.00% घोल में 200 ग्राम क्लोरीन प्रवाहित करने पर घोल का द्रव्यमान 3.9 ग्राम बढ़ जाता है। परिणामी घोल में पदार्थों के द्रव्यमान अंश की गणना करें।
समाधान:
Н2О2 + सीएल2 = О2 + 2Нसीएल
1. घोल में H2O2 की प्रारंभिक मात्रा ज्ञात करें:
n1(H2O2) = m/M(H2O2) = mP-RA ω/ M(H2O2) = 200 0.05/34 =
2. आइए घोल में अवशोषित क्लोरीन की मात्रा इस प्रकार लें एक्स, तो nO2 = x, और समाधान के द्रव्यमान में वृद्धि अवशोषित क्लोरीन और जारी ऑक्सीजन के द्रव्यमान में अंतर के कारण होती है:
m(Cl 2) − m(O 2) = Δ m या x M(Cl 2) − x M(O2) = Δ m;
71x − 32x = 3.9; एक्स = 0.1 मोल.
3. घोल में बचे पदार्थों की मात्रा की गणना करें:
n2(H2O2)ऑक्सीकृत = n(Cl2) = 0.1 mol;
n(H2O2) घोल में शेष = n1 - n2 = 0.294 - 0.1 = 0.194 mol;
एन(एचसीएल) = 2एन(सीएल 2) = 0.2 मोल।
4. परिणामी घोल में पदार्थों के द्रव्यमान अंश ज्ञात करें:
ω(H2O2) = n(H2O2) M(H2O2)/ mP-RA = 0.194 34/203.9 100% = 3.23%;
ω(एचसीएल) = एन(एचसीएल) एम(एचसीएल)/ एमपी-आरए = 0.2 36.5/203.9 100% = 3.58%।
उत्तर:ω(H2O2) = 3.23%;
ω(НCl) = 3.58%।
13. 4.31 ग्राम वजनी मैंगनीज (II) ब्रोमाइड टेट्राहाइड्रेट को पर्याप्त मात्रा में पानी में घोला गया था। परिणामी घोल में क्लोरीन तब तक प्रवाहित किया गया जब तक कि दोनों लवणों की दाढ़ सांद्रता बराबर न हो जाए। गणना करें कि कितना क्लोरीन (संख्या) प्रवाहित किया गया।
समाधान:
Mn Br2 4H2O + Cl2 = MnCl2 + Br2 + 4H2O
1. घोल में मैंगनीज (II) ब्रोमाइड टेट्राहाइड्रेट की प्रारंभिक मात्रा ज्ञात करें:
n(Mn Br2 · 4H2O)आवश्यकता। = एम/एम = 4.31/287 = 1.5 10−2 मोल।
2. दोनों लवणों की दाढ़ सांद्रता की समानता तब होगी जब Mn Br2 · 4H2O की प्रारंभिक मात्रा का आधा उपभोग किया जाएगा। वह। आवश्यक क्लोरीन की मात्रा प्रतिक्रिया समीकरण से पाई जा सकती है:
n(Cl2) = n(MnCl2) = 0.5 n(Mn Br2 · 4H2O) रेफरी। = 7.5·10−3मोल.
वी(सीएल2) = एन·वीएम = 7.5·10−3·22.4 = 0.168 एल।
उत्तर: 0.168 ली.
14. क्लोरीन को 150 मिलीलीटर बेरियम ब्रोमाइड घोल में 0.05 मोल/लीटर की मोलर नमक सांद्रता के साथ तब तक प्रवाहित किया गया जब तक कि दोनों लवणों का द्रव्यमान अंश बराबर नहीं हो गया। गणना करें कि कितना क्लोरीन (200C, 95 kPa) प्रवाहित किया गया।
समाधान:
BaBr2 + Cl2 = BaCl2 + Br2
1. निर्मित लवणों के द्रव्यमान अंशों की समानता से उनके द्रव्यमानों की समानता आती है।
m(BaCl2) = m(BaBr2) या n(BaCl2) M(BaCl2) = n'(BaBr2) M(BaBr2)।
2. आइए हम n(BaCl2) को लें एक्स SM·V − x = 0.15·0.05− x = 7.5·10−3− x के लिए समाधान में शेष mol, और n′(BaBr2) और एक बीजगणितीय समीकरण बनाएं:
208x = (7.5 10−3− x) 297;
2.2275 = 297x +208x;
3. क्लोरीन की मात्रा और उसका आयतन ज्ञात कीजिए:
n(Cl2) = n(BaCl2) = 0.0044 mol;
वी(सीएल2) = एनआरटी/पी = (0.0044 8.314 293)/95 = 0.113 एल।
उत्तर: 113 मि.ली.
15. 100 ग्राम के कुल द्रव्यमान के साथ पोटेशियम ब्रोमाइड और फ्लोराइड का मिश्रण पानी में घोल दिया गया था; परिणामी घोल में अतिरिक्त क्लोरीन प्रवाहित किया गया। वाष्पीकरण और कैल्सीनेशन के बाद अवशेषों का द्रव्यमान 80.0 ग्राम है। परिणामी मिश्रण में पदार्थों के द्रव्यमान अंशों की गणना करें।
समाधान:
1. प्रतिक्रिया उत्पादों के कैल्सीनेशन के बाद, अवशेषों में पोटेशियम फ्लोराइड और क्लोराइड होते हैं:
2KBr + Cl2 = 2KCl + Br2
2. आइए हम KF और KBr की मात्राएँ लें एक्सऔर परतदनुसार, तो
n(KCl) = n(KBr) = y mol.
आइए समानताओं पर आधारित समीकरणों की एक प्रणाली बनाएं:
एम(केएफ) + एम(केबीआर) = 100
एम(केएफ) + एम(केसीएल) = 80
n(KF) M(KF) + n(KBr) M(KBr) = 100
n(KF) M(KF) + n(KCl) M(KCl) = 80
58x + 119y = 100 58x = 100 – 119y
58 x + 74.5y = 80 100 – 119y + 74.5y = 80
44.5y = 20; वाई = 0.45; एक्स = 0.8.
3. आइए अवशेषों में पदार्थों के द्रव्यमान और उनके द्रव्यमान अंश ज्ञात करें:
एम(केएफ) = 58·0.8 = 46.5 ग्राम।
एम(केसीएल) = 74.5 0.45 = 33.5 ग्राम।
ω(केएफ) = 46.5/80·100% = 58.1%;
ω(KCl) = 33.5/80·100% = 41.9%।
उत्तर:ω(केएफ) = 58.1%;
ω(КCl) = 41.9%।
16. सोडियम ब्रोमाइड और आयोडाइड के मिश्रण को अतिरिक्त क्लोरीन पानी के साथ उपचारित किया गया, जिसके परिणामस्वरूप घोल वाष्पित हो गया और कैलक्लाइंड हो गया। सूखे अवशेषों का द्रव्यमान मूल मिश्रण के द्रव्यमान से 2.363 गुना कम निकला। उसी मिश्रण को सिल्वर नाइट्रेट की अधिकता से उपचारित करने के बाद प्राप्त अवक्षेप का द्रव्यमान मूल मिश्रण के द्रव्यमान से कितनी गुना अधिक होगा?
समाधान:
2NaBr + HClO +HCl = 2NaCl + Br2 + H2O
2NaI + HClO +HCl = 2NaCl + I2 + H2O
1. आइए प्रारंभिक मिश्रण का द्रव्यमान 100 ग्राम और इसे बनाने वाले लवण NaBr और NaI की मात्रा लें एक्सऔर परक्रमश। फिर, अनुपात (m(NaBr) + m(NaI))/ m(NaCl) = 2.363 के आधार पर, हम समीकरणों की एक प्रणाली बनाते हैं:
103x + 150y = 100
2.363·58.5(x+y) = 100
एक्स = 0.54 मोल; y = 0.18 मोल.
2. आइए प्रतिक्रियाओं का दूसरा समूह लिखें:
NaBr + AgNO3 = AgBr↓ + NaNO3
NaI + AgNO3 = AgI↓ + NaNO3
फिर, गठित अवक्षेप के द्रव्यमान और पदार्थों के प्रारंभिक मिश्रण (100 ग्राम के रूप में लिया गया) के अनुपात को निर्धारित करने के लिए, AgBr और AgI की मात्रा और द्रव्यमान का पता लगाना बाकी है, जो n(NaBr) और n( के बराबर हैं) NaI), क्रमशः, यानी 0.18 और 0 .54 mol।
3. द्रव्यमान अनुपात ज्ञात कीजिए:
(m(AgBr) + m(AgI))/(m(NaBr) + m(NaI)) =
(M(AgBr) x + M(AgI) y)/100 =
(188 0.18 + 235 0.54)/100 =
(126,9 + 34,67)/100 = 1,62.
उत्तर: 1.62 गुना.
17. मैग्नीशियम आयोडाइड और जिंक आयोडाइड के मिश्रण को अतिरिक्त ब्रोमीन पानी के साथ उपचारित किया गया, जिसके परिणामस्वरूप घोल को वाष्पित किया गया और 200 - 3000C पर कैलक्लाइंड किया गया। सूखे अवशेषों का द्रव्यमान मूल मिश्रण के द्रव्यमान से 1.445 गुना कम निकला। उसी मिश्रण को अतिरिक्त सोडियम कार्बोनेट से उपचारित करने पर प्राप्त अवक्षेप का द्रव्यमान मूल मिश्रण के द्रव्यमान से कितनी गुना कम होगा?
समाधान:
1. आइए हम पदार्थों के प्रारंभिक मिश्रण के द्रव्यमान और परिणामी उत्पादों को m1, m2, m3 के रूप में निरूपित करते हुए प्रतिक्रियाओं के दोनों समूहों को लिखें।
(MgI2 + ZnI2)+ 2Br2 = (MgBr2 + ZnBr2)+ 2I2
(MgI2 + ZnI2)+ 2 Na2CO3 = (MgCO3 + ZnCO3)↓ + 4NaI
एम1/ एम2 = 1.445; एम1/ एम3 = ?
2. आइए प्रारंभिक मिश्रण में नमक की मात्रा इस प्रकार लें एक्स(MgI2) और पर(ZnI2), तो सभी प्रतिक्रियाओं के उत्पादों की मात्रा को इस प्रकार व्यक्त किया जा सकता है
n(MgI2) = n(MgBr2) = n(MgCO3) = x mol;
n(ZnI2) = n(ZnBr2) = n(ZnCO3) = y mol.








 कंपनी के बारे में मॉस्को स्टेट यूनिवर्सिटी में विदेशी भाषा पाठ्यक्रम
कंपनी के बारे में मॉस्को स्टेट यूनिवर्सिटी में विदेशी भाषा पाठ्यक्रम प्राचीन मेसोपोटामिया में कौन सा शहर और क्यों मुख्य बन गया?
प्राचीन मेसोपोटामिया में कौन सा शहर और क्यों मुख्य बन गया? क्यों बुक्सॉफ्ट ऑनलाइन एक नियमित लेखा कार्यक्रम से बेहतर है!
क्यों बुक्सॉफ्ट ऑनलाइन एक नियमित लेखा कार्यक्रम से बेहतर है! कौन सा वर्ष लीप वर्ष है और इसकी गणना कैसे करें?
कौन सा वर्ष लीप वर्ष है और इसकी गणना कैसे करें?